Сложный белок: определение, состав, строение, структура, функции, классификация и характеристика. чем отличаются простые белки от сложных?
Содержание:
- Как лучше употреблять продукты с высоким содержанием белка
- Аминокислотный состав белков
- Ферменты
- Функции белков в клетке
- Так что же такое белок, виды и особенности
- Определение
- Протеин животного происхождения
- Классификация аминокислот по растворимости их радикалов в воде
- Роль печени в синтезе белков
- Хитрости
- Общие структурные особенности аминокислот, входящих в состав белков
- Источники растительного белка для вегетарианцев
- Белок — что это такое и каковы его функции
- Функции белков в организме
- Усваиваемость белка
- Разница в зависимости от происхождения
Как лучше употреблять продукты с высоким содержанием белка
Теперь, когда вы знаете, какие продукты содержат белок, стоит отдельно упомянуть о важности разнообразия поглощаемой нами белковой пищи. Чтобы поступаемый с пищей белок усвоился организмом, пищеварительные ферменты в кишечнике разрушают его на составные аминокислоты
Эти аминокислоты абсорбируются в кровоток и доставляются в разные части тела для создания новых белков (тех же пищеварительных ферментов!) или же для использования в качестве энергии
Чтобы поступаемый с пищей белок усвоился организмом, пищеварительные ферменты в кишечнике разрушают его на составные аминокислоты. Эти аминокислоты абсорбируются в кровоток и доставляются в разные части тела для создания новых белков (тех же пищеварительных ферментов!) или же для использования в качестве энергии.
Есть 9 «незаменимых» аминокислот, которые наше тело не может синтезировать самостоятельно, т. е. они могут поступать к нам только через продукты с высоким содержанием белка. Вот эти аминокислоты:
- Гистидин;
- Изолейцин;
- Лейцин;
- Лизин;
- Метионин;
- Фенилаланин;
- Треонин;
- Триптофан;
- Валин.
По этой причине, полезность богатых протеином продуктов принято оценивать в зависимости от того, насколько полный набор «незаменимых» аминокислот они содержат. С этой точки зрения продукты животного происхождения (мясо, рыба, яйца, молоко) считаются «высококачественными белками». Они поставляют организму все незаменимые аминокислоты.
Что касается растительного белка, то хорошие наборы аминокислот могут быть получены только из комбинаций таких продуктов, как крупы (например, хлеб, макаронные изделия, рис) и бобы (фасоль, горох, чечевица), тофу, орехи и семена. Их не обязательно сочетать все за один прием пищи, поскольку организм способен накапливать аминокислоты в организме
Но это говорит о важности разнообразия белка в нашем рационе. Более того, разные продукты питания включают в себя разные минералы или витамины, многие из которых необходимы для того, чтобы протеины могли выполнять свои функции
Таким образом, здоровое питание – это достижение баланса питательных веществ из потребляемых нами продуктов. В завершение нашей статьи предлагаем вам несколько примеров правильного и полезного сочетания белковых продуктов:
- Бобы (фасоль, горох, чечевица) + молочные продукты (молоко, сыр), например, запеченные бобы с тертым сыром, чечевица с греческим йогуртом;
- Цельные зерна (коричневый рис, кускус, хлеб из цельной пшеницы) + бобовые (фасоль, горох, чечевица), например, ризотто с горохом, лепешка с бобами, цельнозерновой хлеб с арахисовым маслом;
- Бобовые (фасоль, горох, чечевица) + семена и орехи, например, хумус, салат с фасолью и заправкой из льняного масла;
- Молочные продукты (например, молоко, сыр) + цельные зерна, например, сэндвич с хлебом из цельнозерновой муки и сыром, каша с молоком.
Добавляйте специи и зелень в каждое блюдо – они не только содержат белок, но и являются богатыми источниками антиоксидантов. Горстка орехов, семян и сухофруктов – отличный перекус и белково-содержащая замена сладостям на десерт. Однако не стоит и злоупотреблять! Чрезмерное потребление белка может нарушить работу почек, печени и привести к другим неблагоприятным последствиям для здоровья. Кроме того, в среднем мы потребляем около 13 % энергии (калорий) из протеина, а это уже выше рекомендованной нормы в 8-9 %.
Будьте здоровыми!
Аминокислотный состав белков
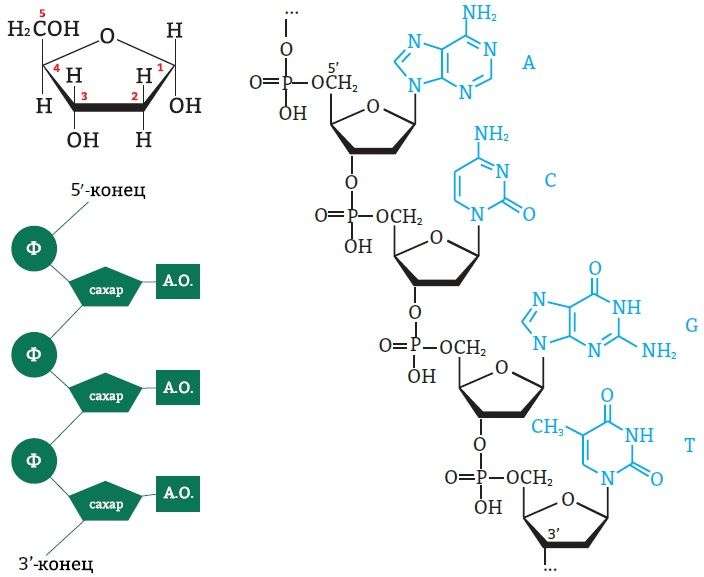
Белки — непериодические полимеры, мономерами которых являются α-аминокислоты. Обычно в качестве мономеров белков называют 20 видов α-аминокислот, хотя в клетках и тканях их обнаружено свыше 170.
В зависимости от того, могут ли аминокислоты синтезироваться в организме человека и других животных, различают: заменимые аминокислоты — могут синтезироваться; незаменимые аминокислоты — не могут синтезироваться. Незаменимые аминокислоты должны поступать в организм вместе с пищей. Растения синтезируют все виды аминокислот.
В зависимости от аминокислотного состава, белки бывают: полноценными — содержат весь набор аминокислот; неполноценными — какие-то аминокислоты в их составе отсутствуют. Если белки состоят только из аминокислот, их называют простыми. Если белки содержат помимо аминокислот еще и неаминокислотный компонент (простетическую группу), их называют сложными. Простетическая группа может быть представлена металлами (металлопротеины), углеводами (гликопротеины), липидами (липопротеины), нуклеиновыми кислотами (нуклеопротеины).
Все аминокислоты содержат: 1) карбоксильную группу (–СООН), 2) аминогруппу (–NH2), 3) радикал или R-группу (остальная часть молекулы). Строение радикала у разных видов аминокислот — различное. В зависимости от количества аминогрупп и карбоксильных групп, входящих в состав аминокислот, различают: нейтральные аминокислоты, имеющие одну карбоксильную группу и одну аминогруппу; основные аминокислоты, имеющие более одной аминогруппы; кислые аминокислоты, имеющие более одной карбоксильной группы.
Аминокислоты являются амфотерными соединениями, так как в растворе они могут выступать как в роли кислот, так и оснований. В водных растворах аминокислоты существуют в разных ионных формах.
Ферменты
Ферменты, или энзимы, — особый класс белков, являющихся биологическими катализаторами. Благодаря ферментам биохимические реакции протекают с огромной скоростью. Скорость ферментативных реакций в десятки тысяч раз (а иногда и в миллионы) выше скорости реакций, идущих с участием неорганических катализаторов. Вещество, на которое оказывает свое действие фермент, называют субстратом.
Ферменты — глобулярные белки, по особенностям строения ферменты можно разделить на две группы: простые и сложные. Простые ферменты являются простыми белками, т.е. состоят только из аминокислот. Сложные ферменты являются сложными белками, т.е. в их состав помимо белковой части входит группа небелковой природы — кофактор. У некоторых ферментов в качестве кофакторов выступают витамины. В молекуле фермента выделяют особую часть, называемую активным центром. Активный центр — небольшой участок фермента (от трех до двенадцати аминокислотных остатков), где и происходит связывание субстрата или субстратов с образованием фермент-субстратного комплекса. По завершении реакции фермент-субстратный комплекс распадается на фермент и продукт (продукты) реакции. Некоторые ферменты имеют (кроме активного) аллостерические центры — участки, к которым присоединяются регуляторы скорости работы фермента (аллостерические ферменты).
Для реакций ферментативного катализа характерны: 1) высокая эффективность, 2) строгая избирательность и направленность действия, 3) субстратная специфичность, 4) тонкая и точная регуляция. Субстратную и реакционную специфичность реакций ферментативного катализа объясняют гипотезы Э. Фишера (1890 г.) и Д. Кошланда (1959 г.).
Э. Фишер (гипотеза «ключ-замок») предположил, что пространственные конфигурации активного центра фермента и субстрата должны точно соответствовать друг другу. Субстрат сравнивается с «ключом», фермент — с «замком».
Д. Кошланд (гипотеза «рука-перчатка») предположил, что пространственное соответствие структуры субстрата и активного центра фермента создается лишь в момент их взаимодействия друг с другом. Эту гипотезу еще называют гипотезой индуцированного соответствия.
Скорость ферментативных реакций зависит от: 1) температуры, 2) концентрации фермента, 3) концентрации субстрата, 4) рН. Следует подчеркнуть, что поскольку ферменты являются белками, то их активность наиболее высока при физиологически нормальных условиях.
Большинство ферментов может работать только при температуре от 0 до 40 °С. В этих пределах скорость реакции повышается примерно в 2 раза при повышении температуры на каждые 10 °С. При температуре выше 40 °С белок подвергается денатурации и активность фермента падает. При температуре, близкой к точке замерзания, ферменты инактивируются.
При увеличении количества субстрата скорость ферментативной реакции растет до тех пор, пока количество молекул субстрата не станет равным количеству молекул фермента. При дальнейшем увеличении количества субстрата скорость увеличиваться не будет, так как происходит насыщение активных центров фермента. Увеличение концентрации фермента приводит к усилению каталитической активности, так как в единицу времени преобразованиям подвергается большее количество молекул субстрата.
Для каждого фермента существует оптимальное значение рН, при котором он проявляет максимальную активность (пепсин — 2,0, амилаза слюны — 6,8, липаза поджелудочной железы — 9,0). При более высоких или низких значениях рН активность фермента снижается. При резких сдвигах рН фермент денатурирует.
Скорость работы аллостерических ферментов регулируется веществами, присоединяющимися к аллостерическим центрам. Если эти вещества ускоряют реакцию, они называются активаторами, если тормозят — ингибиторами.
Функции белков в клетке
- Строительная (пластическая) функция белковых молекул является одной из важнейших.Они являются составным компонентом клеточных мембран и органел. Стенки кровеносных сосудов, сухожилия, хрящи высших животных также состоят в основном из белка.
- Двигательная функция обеспечивается особенными сократительными белками, благодаря которым осуществляются движения жгутиков и ресничек, перемещение хромосом во время деления клеток, сокращение мускулатуры, движения органов растений и т.п., пространственные изменения положения различных структур организма.
- Транспортная функция белков обеспечивается их способностью связывать и переносить с течением крови химические соединения.
Пример 2
Белок крови гемоглобин переносит кислород из лёгких в клетки других органов и тканей (аналогичную функцию в мышцах выполняет миоглобин).
Белки сыворотки крови переносят липиды и жирные кислоты, различные биологически активные вещества.
Молекулы белков, входящих в состав плазматической мембраны, берут участие в транспорте веществ как в клетку, так и из неё.
Белки выполняют и защитную функцию. Как ответ на проникновение внутрь чужеродных веществ (антигенов – белков или высокомолекулярных полисахаридов бактерий, вирусов) в клетке вырабатываются особенные белки – иммуноглобулины (антитела), которые нейтрализуют чужеродные вещества и осуществляют иммунологичную защиту организма.
Благодаря функционированию иммунной системы организма обеспечивается распознавание антигенов антигенным детерминантам (характерным участкам их молекул). Благодаря этому специфически связываются и обеззараживаются чужеродные вещества за.
Замечание 5
Внешнюю защитную функцию могут выполнять также и белки, токсические для других организмов ( белок яда змей).
Белкам свойственна также сигнальная функция. В поверхность клеточной мембранны встроены молекулы белков, которые в ответ на действия факторов внешней среды способны к изменению свей третичной структуры. Так происходит восприятие сигналов из внешней среды и передача команд в клетку.
Регуляторная функция свойственна белкам-гормонам, которые влияют на обмен веществ. Гормоны поддерживают постоянную концентрацию веществ в крови, учавствуют в росте размножении и других жизненно важных процессах.
Пример 3
Одним из наиболее известных гормонов является инсулин, понижающий содержание сахара в крови. В случае стойкой недостаточности инсулина содержание сахара в крови увеличивается и развивается сахарны диабет. Главными регуляторами биохимических процессов в организме могут быть и многочисленные белки-ферменты (каталитическая функция).
Белки являются и энергетическим материалом. При расщеплении 1 г белка до конечных продуктов выделяется 17,6 кДж энергии, необходимой для большинства жизненно важных процессов в клетке.
Так что же такое белок, виды и особенности
В основе природных белков лежат органические соединения аминокислот. В зависимости от их комбинаций получаются различные виды протеинов, каждый из которых оказывает влияние на наш организм. Впервые белок был открыт еще в начале 18 века, точнее – в 1728 году итальянским химиком Бартоломео Якопо Беккари. Но только спустя век ученым удалось определить его строение и выделить входящие в него аминокислоты.
Все белки делятся на две большие группы: растительного или животного происхождения. Каждая из них имеет свои особенности и по-своему воздействует на организм.
Животные белки содержат все необходимые организму аминокислоты, а также витамины группы В, железо, цинк, полезные Омега-3 жирные кислоты, необходимые для правильного усвоения витаминов и улучшения обмена веществ. Но при этом в некоторых источниках животных белков, например, в красном мясе, присутствуют и потенциально опасные для организма холестерин и насыщенные жиры, а также следы используемых в промышленном животноводстве антибиотиков и гормонов роста. Поэтому злоупотреблять такими продуктами не стоит, равно как и полностью исключать их из рациона.
Растительные белки за счет высокого содержания клетчатки и растительных волокон улучшают работу органов пищеварения, а благодаря витаминам и антиоксидантам защищают организм от вредного воздействия окружающей среды
Но важно учесть, что полноценно заменить продукты животного происхождения растительной пищей очень сложно. Содержание белка в них незначительно, и для получения его суточной нормы необходимо потреблять очень большое количество фруктов и овощей
Это стоит учесть приверженцам вегетарианства.
Определение
Итак, белок-фермент – это совокупность сложных молекул белка и рибосом либо их целые комплексы. Именно они ускоряют все происходящие в живых системах химические реакции. Происходит это, разумеется, определенным образом.
Каждый фермент «свернут» в определенную структуру. И он ускоряет конкретную, соответствующую его характеристикам реакцию. Кстати, в таком «тандеме» реагенты именуют субстратами. А получившиеся в результате реакции вещества – продуктами.
Ферменты по отношению к субстратам весьма специфичны. Аденозинтрифосфатазы, например, катализируют исключительно отщепление остатков фосфорной кислоты от аденозинтрифосфорной. Другой пример – киназа фосфорилазы. Она, в свою очередь, переносит к субстрату остатки только фосфорной кислоты.
Протеин животного происхождения
Старший офицер питания продовольственной и сельскохозяйственной организация Эллен Маулхофф (США) говорит, что особенно в развивающихся странах рыба и другое мясо, а также яйца и молоко являются важным источником высокого качества белка и микроэлементов, которые труднее получить из растений. Другие белки животного происхождения, имеющие высокое значение — водорастворимые субпродукты процесса сыроделия.
|
Название продукта |
Количество белка, грамм |
|
Молоко и молочные продукты |
|
|
Масло сливочное несоленое |
0,7 |
|
Молоко (жирность 3,2%) |
2,5 |
|
Сметана обычная (жирность 25%) |
2,7 |
|
Сметана диетическая (жирность 10%) |
2,9 |
|
Кефир жирный |
3,0 |
|
Кефир нежирный |
3,1 |
|
Молоко (жирность 2,5%) |
3,4 |
|
Молоко (жирность 1%) |
4,1 |
|
Творог жирный |
14,2 |
|
Творог средней жирности |
16,7 |
|
Творог нежирный |
17,9 |
|
Мясо |
|
|
Свинина жирная |
11,5 |
|
Корейка |
13,3 |
|
Свинина мясная |
14,7 |
|
Окорок |
15,0 |
|
Говядина |
18,6 |
|
Телятина |
19,9 |
|
Мясо кролика |
20,7 |
|
Субпродукты говяжьи |
|
|
Вымя |
12,2 |
|
Легкое |
15,2 |
|
Печень |
17,3 |
|
Почки |
12,4 |
|
Рубец |
14,8 |
|
Сердце |
14,9 |
|
Язык |
13,5 |
|
Субпродукты свиные |
|
|
Легкое |
14,8 |
|
Печень |
19,0 |
|
Почки |
13,0 |
|
Сердце |
14,9 |
|
Язык |
14,3 |
|
Птица и яйцепродукты |
|
|
Куры |
18,2 |
|
Утки |
15,8 |
|
Индейка |
19,5 |
|
Куриные яйца |
12,7 |
|
Рыба |
|
|
Карась |
17,6 |
|
Карп |
15,9 |
|
Лещ |
17,0 |
|
Минтай |
15,9 |
|
Окунь морской |
17,8 |
|
Окунь речной |
18,4 |
|
Сельдь |
19,4 |
|
Скумбрия |
17,9 |
|
Треска |
17,7 |
|
Хек |
16,7 |
|
Щука |
19,0 |
Классификация аминокислот по растворимости их радикалов в воде
АК
с неполярными Rрадикалы,
имеющие алифатические углеводородные
цепи (радикалы ала, вал, лей, изо, про и
мет) и ароматические кольца (радикалы
фен и три).
АК
с полярными незаряженными Rэти
радикалы
лучше, чем гидрофобные радикалы,
растворяются в воде, т.к. в их состав
входят полярные функциональные группы,
образующие водородные связи с водой. К
ним относят сер, тре и тир, имеющие
гидроксильные группы, асн и глн, содержащие
амидные группы, и цис с его тиольной
группой.
Цистеин
и тирозин содержат соответственно
тиольную и гидроксильную группы,
способные к диссоциации с образованием
Н+,
но при рН около 7,0, поддерживаемого в
клетках, эти группы практически не
диссоциируют.
АК
с полярными отрицательно заряженными
R:
относят
асн и глн аминокислоты, имеющие в радикале
дополнительную карбоксильную группу,
при рН около 7,0 диссоциирующую с
образованием СОО- и
Н+.
Следовательно, радикалы данных аминокислот
— анионы. Ионизированные формы глутаминовой
и аспарагиновой кислот называют
соответственно глутаматом и аспартатом.
АК
с полярными положительно заряженными
R
α-Аминокислоты
могут ковалентно связываться друг с
другом с помощью пептидных связей.
Пептидная связь образуется между
α-карбоксильной группой одной аминокислоты
и α-аминогруппой другой, т.е. является
амидной связью. При этом происходит
отщепление молекулы воды.
1.
Строение пептида. Количество
аминокислот в составе пептидов может
сильно варьировать. Пептиды, содержащие
до 10 аминокислот, называют олигопептиды. Часто
в названии таких молекул указывают
количество входящих в состав олигопептида
аминокислот: трипептид, пентапептид,
окгапептид и т.д.
Пептиды,
содержащие более 10 аминокислот,
называют «полипептиды», а
полипептиды, состоящие из более чем 50
аминокислотных остатков, обычно называют
белками. Однако эти названия условны,
так как термин «белок» часто
употребляют для обозначения полипептида,
содержащего менее 50 аминокислотных
остатков. Например, гормон глюкагон,
состоящий из 29 аминокислот, называют
белковым гормоном.
Мономеры
аминокислот, входящих в состав белков,
называют «аминокислотные
остатки». Аминокислотный
остаток, имеющий свободную аминогруппу,
называется N-концевым и пишется слева,
а имеющий свободную α-карбоксильную
группу — С-концевым и пишется справа.
Пептиды пишутся и читаются с N-конца.
Цепь повторяющихся атомов в полипептидной
цепи -NH-CH-CO-носит название «пептидный
остов».
При
названии полипептида к сокращённому
названию аминокислотных остатков
добавляют суффикс -ил, за исключением
С-концевой аминокислоты. Например,
тетрапептид Сер-Гли-Про-Ала читается
как серилглицилпролилаланин.
Пептидная
связь, образуемая иминогруппой пролина,
отличается от других пептидных связей,
так как атом азота пептидной группы
связан не с водородом, а с радикалом.
Пептиды
различаются по аминокислотному составу,
количеству и порядку соединения
аминокислот

3
Первичная структура белков. Пептидная
связь, ее характеристика (прочность,
кратность, компланарность, цис- ,транс-
изомерия). Значение первичной структуры
для нормального функционирования белков
(на примере гемоглобина S).
Первичная
структура
— понятие, обозначающее последовательность
аминокислотных остатков в белке
Пептидная связь — основной вид связи,
определяющий первичную структуру
Возможно и присутствие дисульфидных
связей между двумя остатками цистеина
в одной полипептидной цепи с образованием
цистина Такая же связь (дисульфидный
мостик) может возникать и между остатками
цистеина, принадлежащими разным
полипептидным цепям в белковой молекуле,
сополимерном образовании.
Аминокислотные
остатки в пептидной цепи белков чередуются
не случайным образом, а расположены в
определённом порядке. Линейную
последовательность аминокислотных
остатков в полипептидной цепи
называют «первичная
структура белка».
Первичная
структура каждого индивидуального
белка закодирована в участке ДНК,
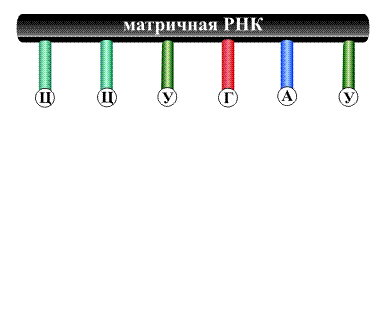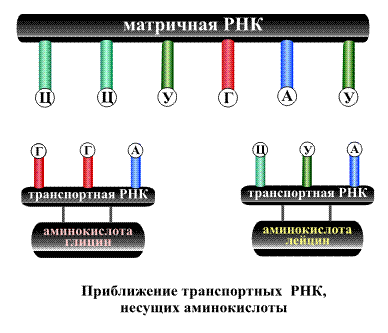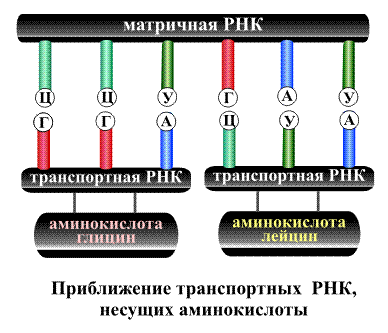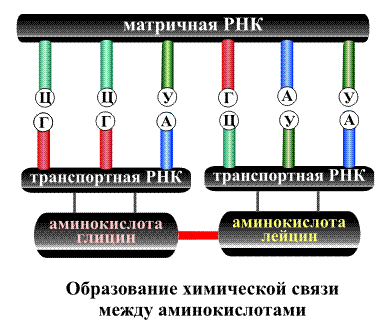
называемом геном. В процессе синтеза
белка информация, находящаяся в гене,
сначала переписывается на мРНК, а затем,
используя мРНК в качестве матрицы, на
рибосоме происходит сборка первичной
структуры белка.
Каждый
из 50 000 индивидуальных белков организма
человека имеет уникальную для данного
белка первичную структуру. Все молекулы
данного индивидуального белка имеют
одинаковое чередование аминокислотных
остатков в белке, что в первую очередь
отличает данный индивидуальный белок
от любого другого
Роль печени в синтезе белков
В печени синтезируются белки, содержащиеся в плазме крови: альбумины, глобулины (за исключением гамма-глобулинов), фибриноген, нуклеиновые кислоты и многочисленные ферменты, из которых некоторые синтезируются только в печени, например ферменты, участвующие в образовании мочевины.
Белки, синтезированные в организме, входят в состав органов, тканей и клеток, ферментов и гормонов (пластическое значение белков), но не запасаются организмом в виде разных белковых соединений. Поэтому та часть белков, которая не имеет пластического значения, при участии ферментов дезаминируется – распадается с освобождением энергии на разные азотистые продукты. Период полураспада белков печени равен 10 дням.
Хитрости
Неважно каким образом вы получаете свою суточную норму протеина, для облегчения этой задачи можете прислушаться к советам ниже:
- Не старайтесь получить суточную норму за один прием пищи
Белковая пища не проста для переваривания, поэтому для облегчения процесса пищеварения удобнее будет распределить вашу норму белков на несколько приемов пищи.
- Ешьте протеин сразу после тренировки
Это особенно важно, если вы занимались аэробикой (бегом, к примеру), потому что протеин нужен для восстановления мышц, а углеводы нужны для пополнения энергии. Помните: Все макронутриенты (углеводы, жир, протеин) лучше всего работают вместе
- Употребляйте больше растительного протеина
Неважно: вегетерианец вы или нет, растительный протеин пригодится всем. В дополнение к богатым запасам белка, бобовые, семена, киноа и чечевица также богаты в клетчатке, витаминах и минералах
- Выбирайте нежирные куски мяса
Дорогие мясоеды, выбирая свиное или говяжье мясо, выбирайте нежирные срезы. Шея и филе обычно практически не содержат жира.
Такие куски потребуют больше термической обработки, чем жирные, но, при верном приготовлении, будут также вкусы. Если вы любите стейки или бургеры, ограничьте количество потребляемого красного мяса до 1 или 2 раз в неделю, потому что в нём высок процент насыщенного жира.
- Выбирайте птицу с умом
Если убрать с тушки кожу, то мясо у птиц обычно нежирное – но с покупным мясом будьте поаккуратнее. Если на упаковке не указано, что продукт обезжирен, то, скорее всего, вас ждет индейка или курица с кожей и жиром, что мало чем будет отличаться от той же говядины.
- Введите больше рыбы в свой рацион.
Если вам нравится рыба, постарайтесь съедать 85 – 115 г. Рыбьего мяса пару раз в неделю
Неважно: замороженная или свежая, рыба – прекрасный источник протеина, а, к примеру, лосось, также богат в омега-3 и в полезных ненасыщенных жирах
https://blog.myfitnesspal.com/essential-guide-to-protein/
Общие структурные особенности аминокислот, входящих в состав белков
Общая
структурная особенность АК — наличие
амино- и карбоксильной групп, соединённых
с одним и тем же углеродным атомом. R —
радикал аминокислот — в простейшем
случае представлен атомом водорода
(глицин), но может иметь и более сложное
строение.
В
водных растворах при нейтральном
значении рН —
АК существуют в виде биполярных ионов.
В
отличие от 19 остальных — АК, пролин —
Иминокислота, радикал которой связан
как с углеродным атомом, так и с
аминогруппой, в результате чего молекула
приобретает циклическую структуру.
19
из 20 АК содержат в α-положении асимметричный
атом углерода, с которым связаны 4 разные
замещающие группы. В результате эти АК
в природе могут находиться в двух разных
изомерных формах — L и D. Исключение
составляет глицин, который не имеет
асимметричного α-углеродного атома,
так как его радикал представлен только
атомом водорода. В составе белков
присутствуют только L-изомеры аминокислот.
Чистые
L- или D-стереоизомеры могут за длительный
срок самопроизвольно и неферментатив-но
превращаться в эквимолярную смесь L- и
D-изомеров. Этот процесс называют
рацемизацией. Рацемизация каждой
L-аминокислоты при данной температуре
идёт с определённой скоростью. Это
обстоятельство можно использовать для
установления возраста людей и животных.
Так, в твёрдой эмали зубов имеется белок
дентин, в котором L-аспартат переходит
в D-изомер при температуре тела человека
со скоростью 0,01% в год. В период формирования
зубов в дентине содержится только
L-изомер, поэтому по содержанию D-аспартата
можно рассчитать возраст обследуемого.
Все
20 АК в организме человека различаются
по строению, размерам и физико-химическим
свойствам радикалов, присоединённых к
α-углеродному атому.
Источники растительного белка для вегетарианцев
Если вы не употребляете продукты животного происхождения, ваша главная задача – подобрать рацион, который обеспечит организм всеми необходимыми компонентами.
Вы должны учесть, что, например, рис содержит слишком мало лизина, чтобы считаться полноценным источником белка. Но употребляя его с фасолью или салатом с чечевицей, вы получите все девять незаменимых аминокислот.
Какие продукты растительного происхождения содержат большое количество белков?
- Киноа – это зерно без глютена, которое содержит 8 граммов белка на 1 приготовленную чашку (185 граммов). В состав крупы входит множество полезных минералов, в том числе магний, железо и цинк.
- Тофу – сыр, который изготавливается из соевого молока. Употребление 85 г дает приблизительно 8 г белка. Содержит кальций, калий и железо.
- Гречневая крупа. Одна чашка (168 грамм) вареной гречневой крупы дает приблизительно 6 грамм белка. Является источником многих важных минералов, включая фосфор, марганец, медь, магний и железо.
- Спирулина – разновидность сине-зеленых водорослей, 1 столовая ложка (7 г) высушенной спирулины дает 4 г белка. Она богата антиоксидантами и является источником нескольких витаминов группы В, меди и железа.
- Семена чиа. Две столовые ложки (28 г) семян дают 4 грамма белка. Является хорошим источником Омега-3, железа, кальция, магния и селена.
- Рис и бобы – классическое сочетание, которое является источником полноценного белка. Одна чашка (239 г) риса и бобов дает 12 г белка и 10 г клетчатки.
- Орехи. Например, 30 г миндаля дает 6 граммов белка, почти столько же содержится в 30 г жареного стейка рибай.

Продукты растительного происхождения, содержащие много белка
Белок — что это такое и каковы его функции
Белок является органическим соединением, классифицированным как биополимеры. Он состоит из многих аминокислот и выполняет строительную функцию в организме, формируя соединительную ткань, мышцы, кости, волосы, зубы и ногти.
Белки создаются в результате синтеза, они необходимы для возникновения биохимических процессов, которые отвечают за правильную работу всех органов человеческого тела.
- являются важным материалом для создания новых и восстановления использованных тканей. Они занимают первое место среди твердых компонентов человеческого организма — они составляют 75% сухой массы мягких тканей тела;
- белки, не используемые для анаболических процессов, являются источником энергии, при сжигании 1 г белка вырабатывается 4 ккал;
- являются основным компонентом жидкостей организма: кровь, интерстициальная жидкость (содержится в межклеточном пространстве), коровье и грудное молоко;
- организм создает из них белковые части пищеварительных и тканевых ферментов. Дефицит протеина в рационе через несколько дней отражается на количестве и активности ферментов;
- белки являются материалом для биосинтеза белковых гормонов;
- являются материалом для биосинтеза иммунных органов;
- участвуют в детоксикации организма.
Это органическое соединение особенно важно для спортсменов, потому что оно влияет на наращивание мышечной массы и силы. По этой причине на рынке нет недостатка в белковых добавках, которые способствуют правильному балансу диеты
Функции белков в организме
Белки принимают участие абсолютно во всех жизненно важных процессах, таких как обмен веществ, рост, развитие организма и репродуктивная функция.
Основные функции белков в организме
- Формирование мышечных волокон.Аминокислоты представляют собой маленькие «кирпичики», которые являются основой для роста мышц, хрящей, волос и ногтей.
- Сортивление инфекциям.В ответ на попадание в организм чужеродных белков и микроорганизмов (инфекции, вирусы), образуются особые белки-антитела, которые связываются с «плохими» белками и обезвреживают их.
- Поддержка хорошего гормонального фона.Входя в состав большинства гормонов, белки участвуют в нормализации процесса обмена веществ (ускоряя его на 30%), регулируют уровень сахара в крови (гормон инсулин) и способствуют синтезу гликогена.
- Ускорение обмена веществ.Белки ускоряют биохимические процессы, происходящие в клетках. На примере бодибилдинга это значит, что тело быстрее становится рельефным.
- Энергообмен.Белки участвуют в пищеварительном процессе и энергетическом обмене. При распаде 1 г белка выделяется 18 кДж энергии. Однако в качестве источника энергии белки используются организмом только тогда, когда исчерпаны основные источники (углеводы и жиры).
- Доставка питательных веществ.Протеины участвуют в транспортировке кислорода, некоторых витаминов, минералов, углеводов, жиров, гормонов и других веществ. Они переносят кислород ко всем тканям и органам, а от них в легкие переносят углекислый газ.
После попадания внутрь, белки начинают расщепляться в желудочно-кишечном тракте (благодаря ферментам) до более простых соединений — аминокислот.
Затем они всасываются стенками кишечника, попадают кровеносную систему и транспортируются ко всем органам и тканям в нашем организме.
Усваиваемость белка
При употреблении таких веществ, стоит помнить о чувстве меры. Избыточное количество белков представляет определенную опасность. Они с трудом перевариваются и могут вызвать нарушения пищеварительных функций.
Проблемы с усвоением белков могут возникать в следующих ситуациях:
- Избыточное количество белка за 1 прием пищи. За 1 прием организм не может усвоить больше 35 г белков. Помимо этого, избыток таких веществ отрицательно влияет на пищеварительные функции. Организм не способен переварить большое количество протеинов. Как следствие, неусвоенная часть начинает гнить в пищеварительных органах. Это провоцирует запоры, увеличение ацетона и нарушения в работе поджелудочной железы.
- Систематическое переедание. Диетологи советуют придерживаться принципов дробного питания – 4-5 раз в день. Это помогает лучше переваривать пищу, в том числе и белки.
- Употребление большого количества трудноперевариваемых белков. Протеины могут усваиваться в разном объеме. Есть белки, которые легко перевариваются. Однако существуют и трудноперевариваемые продукты. Эталоном белковой пищи считаются куриные яйца. Также к легким белкам относят нежирные кисломолочные продукты, куриное филе, кролика.
- Исключение жиров. Безусловно, жирные продукты содержат большое количество калорий и с трудом усваиваются. Однако полностью отказываться от них не следует. Это чревато гормональными нарушениями, ухудшением состояния волос и кожи. Также исключение жиров провоцирует нарушение процесса переваривания белков. Чтобы обеспечить эффективную работу печени и выведение продуктов синтеза белка, стоит включать в рацион желчегонные жиры. Они присутствуют в оливковом и кунжутном маслах.
- Дефицит жидкости. Нарушение питьевого режима провоцирует разные проблемы, включая ухудшение усвоения белка. В сутки человек должен пить 30-40 мл воды на 1 кг массы тела. В жаркую погоду или при серьезных физических нагрузках норма дополнительно повышается на 500-800 мл.
- Неправильные дополнения к белкам. Чтобы протеины усваивались максимально хорошо, их рекомендуется сочетать с овощами. В такой пище присутствуют ферменты и клетчатка. Это облегчает переваривание белков.
Разница в зависимости от происхождения
Как понять, какие стоит употреблять белки? Происхождение белков влияет на количество получаемой нормы полезных веществ. Но их отличие заключается не только в этом.
Существует информация, что основной разницей между белками животного и растительного происхождения являются их профили аминокислот. Белки животные, конечно, гораздо больше похожи на наши, таким образом, усваиваются легче и быстрее, чем растительные. Белки растительного происхождения несколько скомпрометированы их ограниченным содержанием аминокислот.
Согласно заключениям Гарвардской школы общественного здравоохранения (ГШОЗ), животный белок имеет сбалансированное сочетание всех аминокислот, поэтому его называют полным белком, растительный же белок является неполным.
Есть множество дополнительных факторов, которые должны быть рассмотрены при анализе белков в рационе питания. ГШОЗ утверждает: «Животный белок и растительный белок, вероятно, оказывают те же эффекты на здоровье».
Исследователи этой школы обнаружили, что шесть унций порции жареного бифштекса и лосося обеспечивает 38 и 34 грамма белка соответственно. Но в то время стейк также содержит 44 грамма жира, а лосось содержит 18 грамм. Приготовленная чашка чечевицы, тем временем, предлагает меньше белка (лишь 18 грамм), но зато и содержит меньше одного грамма жира.
Но бесспорно, что и белки растительного происхождения имеют свои преимущества:
- они меньше окисляют нашу кровь из-за большего количества в них минералов;
- содержат меньше примесей;
- содержат меньше жира;
- в них отсутствует вредный холестерин;
- во время приема растительной пищи идет меньшая нагрузка на печень и почки;
- легко усваиваются.