Бактериологический метод исследования: этапы, цели, характеристика
Содержание:
- 6.10.1. Санитарно-показательные микроорганизмы
- Питательные среды
- Расшифровка результатов
- Теоретическая справка
- 3.1. Исследования бактериальной обсемененности воздушной среды
- Для чего необходимо бактериологическое исследование?
- Необходимые для исследования материалы
- Виды бактериоскопии анализов
- Забор и транспортировка
- Бакпосев при беременности
- Значение биологического метода исследования
- Микробиологическая диагностика эшерихиозов
- Основные методы микроскопии
- Последовательность действий и особенности методики
- Регламентирующие документы
6.10.1. Санитарно-показательные микроорганизмы
Санитарно-показательные
микроорганизмы (СПМ)
– это представители нормальной
микрофлоры, которые выделяются
естественным путем в окружающую среду
и там сохраняются, поэтому служат
показателями санитарного неблагополучия,
потенциальной опасности исследуемых
объектов. Так, если на объектах обнаруживают
нормальных обитателей кишечника, делают
заключение о наличии фекального
загрязнения и возможном присутствии
патогенных энтеробактерий. Так как
патогенных представителей меньше и
выделить их труднее, то вначале выявляют
санитарно-показательные микроорганизмы
в окружающей среде, а после их выявления
можно проводить поиск патогенных.
СПМ условно
разделяют на 3 группы:
1.Группа
А включает
обитателей кишечника человека и животных,
эти микроорганизмы расценивают как
индикаторы фекального загрязнения. В
нее входят бактерии группы кишечной
палочки (БГКП) – эшерихии, энтерококки,
протеи, сульфитвосстанавливающие
клостридии (С.
perfringens),
термофилы, бактериофаги, ацинетобактер,
аэромонады.
2.Группа
В включает
обитателей верхних дыхательных путей
и носоглотки. В нее входят a-
и b-гемолитические
стрептококки, стафилококки
(плазмокоагулирующие, лецитиназоположительные,
гемолитические и антибиотикоустойчивые).
3.Группа
С включает
сапрофитические микроорганизмы,
обитающие во внешней среде, их расценивают
как индикаторы процессов самоочищения.
В нее входят бактерии-аммонификаторы,
бактерии-нитрификаторы, некоторые
спорообразующие бактерии, грибы,
актиномицеты, целлюлозобактерии,
сине-зеленые водоросли.
Санитарно-показательные
микробы должны отвечать следующим
требованиям:
они должны постоянно содержаться в
выделениях человека и теплокровных
животных и поступать в окружающую среду
в больших количествах; не должны иметь
другого природного резервуара, кроме
организма человека и животных; после
выделения их в окружающую среду, должны
сохранять жизнеспособность в течение
сроков, близких к срокам выживания
патогенных микробов, выводимых из
организма теми же путями; СПМ не должны
размножаться в окружающей среде; не
должны изменять свои биологические
свойства в окружающей среде; должны
быть типичными, чтобы их диагностика,
индикация и идентификация осуществлялась
без особого труда.
Санитарно-показательные
бактерии окружающей среды.
1.Вода
– бактерии группы кишечной палочки
(БГКП), энтерококки, стафилококки.
2.Почва
– БГКП, энтерококки, термофилы, возбудители
газовой гангрены.
3.Воздух
– бета-гемолитические стрептококки,
стафилококки.
4.Пищевые
продукты – БГКП, энтерококки, стафилококки,
протей.
5.Предметы
обихода – БГКП, фекальные стрептококки,
стафилококки.
Питательные среды
|
Мясо-пептонный
Тип
Состав
Питательная |
Вывод:
(опишите рост кишечных палочек и
стафилококков)____________________
______________________________________________________________________________________________________________________________________________
|
Среда
Тип
Состав
Питательная Дифференцирующий Индикатор_________________________________ |
Вывод:
(опишите рост кишечных палочек и
сальмонелл)_______________________
______________________________________________________________________________________________________________________________________________
|
Солевой
Тип
Состав
Питательная Элективный |
Вывод:
(опишите рост кишечных палочек и
стафилококков)____________________
______________________________________________________________________________________________________________________________________________
|
Среда
Тип
Состав
Питательная Элективный Дифференцирующий Индикатор_________________________________ |
Вывод:
(опишите рост кишечных палочек и
сальмонелл)_______________________
______________________________________________________________________________________________________________________________________________
|
Желточно-солевой
Тип
Состав
Питательная Элективный Дифференцирующий Индикатор_________________________________ |
Вывод:
(опишите рост S.aureus
и S.saprophiticus)______________________________
______________________________________________________________________________________________________________________________________________
|
Мясо-пептонный
Тип
Состав
Питательная |
Вывод:
(опишите рост кишечных палочек и
стафилококков)____________________
______________________________________________________________________________________________________________________________________________
|
Селенитовый
Тип
Состав
Питательная Элективный |
Вывод:
(опишите рост кишечных палочек и
сальмонелл)_______________________
______________________________________________________________________________________________________________________________________________
|
Солевой
Тип
Состав
Питательная Элективный |
Вывод:
(опишите рост кишечных палочек и
стафилококков)____________________
______________________________________________________________________________________________________________________________________________
Расшифровка результатов
Стандартный результат сводится к двум пунктам анализа:
- качественный анализ с определением факта наличия/отсутствия определенного возбудителя;
- количественный анализ с указанием числа микроорганизмов на единицу объема – выражают в КОЕ (колониеобразующие единицы). Чем выше этот показатель, тем сильнее бактериальное поражение организма данным возбудителем.
Внимание! Отрицательный результат является относительным и показывает отсутствие патогенных организмов лишь в отдельно взятой порции материала. Для большей объективности данных требуется повторное обследование
Дополнительно указывают чувствительность микроорганизмов к основным классам антибактериальных средств – пенициллинам, тетрациклинам, цефалоспоринам, макролидам. Чем выше показатель чувствительности, тем успешнее будет лечение данным антибиотиком.
Теоретическая справка
Семейство
Enterobactericeaeвключает 12
родов:Escherichia,Salmonella,Shigellaи др. бактерии этого
семейства имеют общие морфологические
и физиологические свойства: все они
грамотрицательные палочки, без спор,
неприхотливы к питательным средам,
факультативные анаэробы, имеют
многочисленные сахаролитические,
протеолитические ферменты. Антигенное
строение служит одним из существенных
критериев, на которых основывается
классификация, а так же идентификация
энтеробактерий. Различают три типа
антигенов: О-соматический, у некоторых
Н-жгутиковый, К-антигены, у энтеробактерий
обнаружены общие антигены. Один них –
антиген Кунига – связан с ЛПС.
3.1. Исследования бактериальной обсемененности воздушной среды
3.1.1. Исследования бактериальной обсемененности
воздушной среды проводят в помещениях лечебных организаций в зависимости от их
функционального назначения на санитарно-микробиологические показатели:
общее количество микроорганизмов в 1 м3
воздуха (КОЕ/м3);
количество колоний S.
aureus в 1 м3 воздуха (КОЕ/м3);
количество плесневых и дрожжевых грибов в
1 м3 воздуха.
3.1.2. Пробы воздуха отбирают
аспирационным методом с помощью аппаратов и устройств, разрешенных к применению
в установленном порядке.
Количество пропущенного воздуха должно
составлять 100 дм3 для определения общего количества
микроорганизмов, дрожжевых и плесневых грибов и 250 дм3 для
определения S. aureus. Исследование воздуха седиментационным методом не
допускается.
3.1.3. Для определения общего количества
микроорганизмов в 1 м3 воздуха забор проб проводят на питательный
агар типа МПА, СПА, ГРМ-агар и другие, приготовленные согласно инструкций по
применению. Посевы инкубируют при температуре 37 °С в течение (48 ± 2) ч,
подсчитывают количество выросших колоний и производят перерасчет на 1 м3
воздуха. При наличии роста колоний дрожжевых и плесневых грибов, их
подсчитывают и делают пересчет на 1 м3 воздуха. В протоколе
количество дрожжевых и плесневых грибов указывают отдельно.
Примечание: При переносе аппаратов и
устройств для отбора проб воздуха из одного помещения в другое их поверхность
обрабатывают раствором дезинфицирующего средства. Столик, внутренние стыки,
крышку и прочие части прибора с внутренней и внешней стороны протирают спиртом
(70 %).
1. Первый день.
Для определения наличия S.
aureus забор проб проводят на желточно-солевые среды на
основе сред: элективно-солевой агар, стафилококк-агар, маннитолагар или среда №
10 по ГФ XII, агар Байд-Паркер. Чашки с посевами инкубируют в
термостате при 37 °С (48 ± 2) ч.
2. Второй-третий день.
На вышеуказанных средах стафилококк
растет в виде круглых, блестящих, маслянистых, выпуклых, пигментированных
колоний. Следует учитывать, что стафилококки, выделенные от человека, дают
положительную лецитовителлазную реакцию в 60 — 70 % случаев. Отвивка на
скошенный агар для дальнейшего исследования не менее 2 колоний, подозрительных
на стафилококк. Для исследования отвивают прежде всего колонии, дающие положительную
лецитовителлазную реакцию (образование радужного венчика). При отсутствии на
чашках таких колоний дальнейшему исследованию подвергаются пигментированные
колонии, схожие по морфологии со стафилококком. При одновременном наличии на
чашках колоний стафилококка, отличающихся по пигменту, следует отвивать не
менее двух колоний различного вида. Пробирки с посевом помещают в термостат при
37 °С на (24 ± 2) ч.
3. Четвертый день.
После инкубации у выделенных штаммов
проверяют морфологию, тинкториальные свойства (окраска по Граму) и наличие
плазмокоагулирующей активности в реакции плазмокоагуляции (РПК).
Окраску по Граму проводят общепринятым
методом. Под микроскопом окрашенные по Граму стафилококки имеют вид
фиолетово-синих кокков, располагающихся гроздьями или небольшими кучками
(«кружево»).
Если культура обладает только
плазмокоагулирующей или только лецитовителлазной активностью, то для
окончательного ответа требуется учитывать другие признаки, позволяющие
определить принадлежность штамма к виду S. aureus (ферментация маннита, гемолитическая активность).
При необходимости, после выделения чистой
культуры, проводят определение чувствительности/устойчивости к антибиотикам,
дезинфицирующим средствам, бактериофагам.
4. Пятый день.
Учет результатов дополнительных тестов.
Окончательная выдача ответа.
Для чего необходимо бактериологическое исследование?
Бактериологические исследования позволяют идентифицировать возбудителя болезни и установить его степень чувствительности к определенным антибиотикам для выявления эффективности лечения. Данный метод исследования широко применяется в медицинской практике инфекционистами, отоларингологами, гинекологами, урологами, онкологами, хирургами и другими специалистами. Он назначается при любых воспалительных заболеваниях в организме и при подозрении на развитие сепсиса.
Как правильно осуществить забор материала?
Материалом для бактериологических исследований может служить кровь, ликвор, мокрота, испражнения, моча, желчь, спинномозговая жидкость, грудное молоко, выделения из ротовой полости, половых органов, зева, носоглотки и ран.
Главное требование забора – стерильность посуды и инструментов. При несоблюдении этого требования результаты окажутся совершенно неправильными, так как произойдет обсеменение собранного материала.
Брать биологический материал для исследований следует до начала приема антибиотиков. В противном случае результат существенно исказится.
Полученный материал необходимо немедленно доставить в лабораторию, чтобы не допустить его гибели.
В нашей лаборатории забор биологических жидкостей выполняется в абсолютно стерильных условиях специально обученными медсестрами в соответствии со всеми правилами, что гарантирует качество собранного материала и достоверность полученных результатов.
Как проходит исследование?
Бактериологические исследования включают несколько этапов, на проведение которых требуется от 3 до 10 дней.
Чтобы выделить чистую культуру возбудителя, осуществляют посев полученного материала на специальную питательную среду, на которой способен жить только определенный вид микроорганизмов. Например, для идентификации дифтерийной палочки применяют теллуритовую среду, а для обнаружения кишечной палочки – среду Эндо. Если требуется выделить условно-патогенные микроорганизмы, то пользуются универсальными питательными средами, чаще всего кровяным агаром.
Питательную среду помещают в термостат, чтобы создать оптимальные условия для роста и размножения микроорганизмов.
По истечении определенного времени производят контрольный осмотр полученных колоний
Если необходимо, используют специальные красители, позволяющие обнаружить определенные штаммы бактерий.
При контрольном осмотре обращают внимание на цвет, форму и плотность колонии, ее способность к разложению некоторых органических и неорганических соединений. Затем с помощью специальных методов подсчитывают количество микроорганизмов в образце.
Плюсы и минусы бактериологического исследования
Бактериологический посев имеет несколько преимуществ:
- характеризуется высокой специфичностью;
- позволяет проводить исследование любой биологической жидкости;
- дает возможность определить чувствительность патогенного микроорганизма к определенному лекарству и правильно подобрать терапию.
Но есть у этого метода и некоторые недостатки:
- результат можно получить только по происшествии нескольких дней;
- требует высокой квалификации персонала бактериологической лаборатории;
- предъявляет высокие требования к забору материала.
Результат исследования
Результатом бактериологического исследования является обнаружение возбудителя (или его отсутствие) в собранном материале и выявление его концентрации, что позволяет подобрать результативную терапию и эффективно избавиться от возбудителей.
Необходимые для исследования материалы
Для изучения анализов по бактериоскопическому методу необходимы следующие инструменты:
- Металлическая петля.
- Предметное стекло. Этот предмет обязательно должен быть чист, так как любое его загрязнение может повлиять на состояние образца.
- Пинцет.
- Фильтровальная бумага.
Очистка новых предметных стекол производится с помощью 1%-ного раствора соды. После кипячения в таком растворе стекло промывается дистиллированной водой, слабым раствором соляной кислоты, а затем снова дистиллированной водой. Бывшие в употреблении стекла очищаются в несколько этапов: сначала их помещают в раствор серной кислоты на 60-120 минут, затем кипятят в растворе соды, после чего производится промывка стекла водой. После этого стекло опускают в медицинский спирт.
Хранить приборные стекла нужно либо в спирте, либо в плотно закрытых емкостях. Причем в последнем случае стекла должны быть сухими.
Для данного исследования также понадобятся следующие химические реактивы:
- Спирт;
- Раствор Люголя;
- Красители.
Наиболее часто используемыми красителями являются фуксин Циля, метиленовый синий и карболовый генцианвиолет. Последний краситель представляет из себя раствор обычного фуксина в пятипроцентной карболовой воде
Виды бактериоскопии анализов
Бактериоскопия анализов кала
Для бактериоскопического исследования анализа кала необходим образец анализа пациента. Если необходимо провести анализ микрофлоры кишечника, нарушения в составе которой свидетельствуют о наличии дисбактериоза или инфекционных заболеваний пищеварительной системы, забор образца проводится с помощью петли, которая вводится в анальное отверстие примерно на 10 сантиметров вглубь.
При исследовании образца кала могут быть обнаружены следующие опасные микроорганизмы:
- Стафилококки.
- Клебсиелла, наличие которой свидетельствует о поражении толстой кишки.
- Синегнойная палочка, выделяющая крайне опасные для человека токсины.
Наличие синегнойной палочки в организме человека может привести к заражению крови и менингиту – заболеваниям, которые могут иметь летальный исход.
Бактериоскопия анализов мочи
Анализ мочи для бактериоскопического исследования сдается при подозрении на воспаление мочевыделительной системы и наличие таких болезней, как пиелонефрит и цистит, возбудителями которых являются кишечная палочка и некоторыми возбудителями заболеваний, передающихся половым путем, соответственно. Для такого исследования необходимо от 50 до 100 мл мочи, причем моча должна храниться в стерильном контейнере. Перед сдачей анализа необходимо хорошо подмыться, чтобы в моче было меньше сторонних примесей. Не рекомендуется сдавать мочу во время менструации.

Бактериоскопический анализ мочи незаменим для обнаружения заболеваний мочевыделительной системы у грудных детей. В этом случае моча собирается через катетер в стерильную емкость. Исследование образца мочи необходимо провести в кратчайшие сроки, иначе обнаружение возбудителей заболеваний будет затруднено.
Бактериоскопия мокроты
При анализе мокроты исследуются два мазка. Один из них изучается на предмет наличия палочек Коха – возбудителей туберкулеза. По результатам исследования второго делаются выводы о наличии в мокроте других микробов.
Для анализа на предмет наличия других микробов образец окрашивают по методу Грама. С помощью бактериоскопического метода с применением окрашивания по методу Грама возможно выявление пневмококка – бактерии, являющейся причиной пневмонии. Также при работе с образцом по такой схеме можно выявить наличие в мокроте стрептококков – возбудителей ангины, а также золотистого стафилококка. Последний микроорганизм представляет особую опасность для здоровья человека. Он провоцирует гнойные процессы и образование абсцессов, в том числе и на внутренних органах.
Забор и транспортировка
Для проведения исследования требуется правильно подготовить воду. Ее забор делается по схеме:
- Берется только стерильная бутылка.
- Водопроводный кран, откуда будет делаться забор воды, предварительно обжигается.
- Из крана на протяжении 7-10 минут должна сливаться вода. Только после этого ее можно набирать в стерильную емкость.
- Тара наполовину набирается водой, закрывается пробкой и перевозится в лабораторию. При этом вода при доставке к месту анализа не должна контактировать со стерильной пробкой.
Для исследования подходит только та вода, с момента забора которой прошло не больше 1,5 часа.
Сам анализ проводится по следующему плану:
- Осуществляют подготовку лабораторной посуды и всех материалов. Вся посуда стерилизуется, промывается и тщательно сушится. Стерилизация происходит в сушильном шкафу. Температура внутри него должна быть порядка 160-165С. Посуда обрабатывается сухим жаром на протяжении часа. Вместо сушильного шкафа может применяться автоклав. В нем температура ниже – порядка 126С. Обработка длится полчаса.
- Простерилизованную посуду вынимают из шкафа только после того, когда он остынет до температурных значений меньше 60С.
- Обработанную посуду помещают в лабораторные шкафы. Они должны плотно закрываться.
- Готовят стерильную воду. Сначала исследуемая вода разливается по флаконам, которые закрываются пробками. После этого флаконы с водой стерилизуются в автоклаве в течение 20 минут при температуре 120С. Такая вода пригодна для использования в течение 2 недель.
- Готовят питательную среду. Ее компонентами может быть как мясной бульон, так и глюкоза, лактоза или фильтрованная желчь скота.
- Готовят химические реактивы для конкретного анализа.
- Подготовленную питательную среду ставят на водяную баню, после чего охлаждают до 45-50С.
- Расставляют стерильные чаши с пометками.
- Берут несколько проб питательной среды и делают два посева в стерильные чаши.
- Колбы со взятой для анализа воды открывают, обжигают их горлышки и немного продувают их воздухом через пипетку. Она должна быть стерильной.
- Чистой палочкой делается забор воды. Она добавляется в стерильные чаши, которые закрываются пробкой.
- Взятая вода заливается остуженным питательным раствором. Чаша со смесью быстро перемешивается вращательными движениями. Далее чаша ставится на ровную поверхность. Смесь внутри нее должна застыть.
- Чаша с застывшим раствором переворачивается вверх дном и ставится в термостат. Там создается оптимальная среда для выращивания посевов (37С). Чаша находится в термостате сутки.
- Чаша с выращенными колониями микроорганизмов кладется на затемненный фон вверх дном. При помощи лупы делается подсчет количества появившихся колоний бактерий. При подсчетах учитывается число микроорганизмов на 1 см3 взятой для анализа воды.
- Результаты фиксируются в протоколе и регистрационном журнале. Дополнительно фиксируются особые условия, при которых проходил анализ.
Бакпосев при беременности
Любая бактериальная инфекция, «дремлющая» в организме женщины, может отрицательно повлиять на течение беременности, привести к заражению плода, а в некоторых случаях даже спровоцировать выкидыш на ранних сроках. Чтобы обезопасить себя и будущего ребенка от различных патологий, необходимо осознанно подходить к планированию зачатия и при необходимости проводить соответствующую антибактериальную терапию.
Среди показаний для проведения бакпосева выделяют следующие:
- наличие воспалительных заболеваний половых органов и мочеполовой системы;
- выявление причин невынашиввания при предварительном диагнозе — бесплодие;
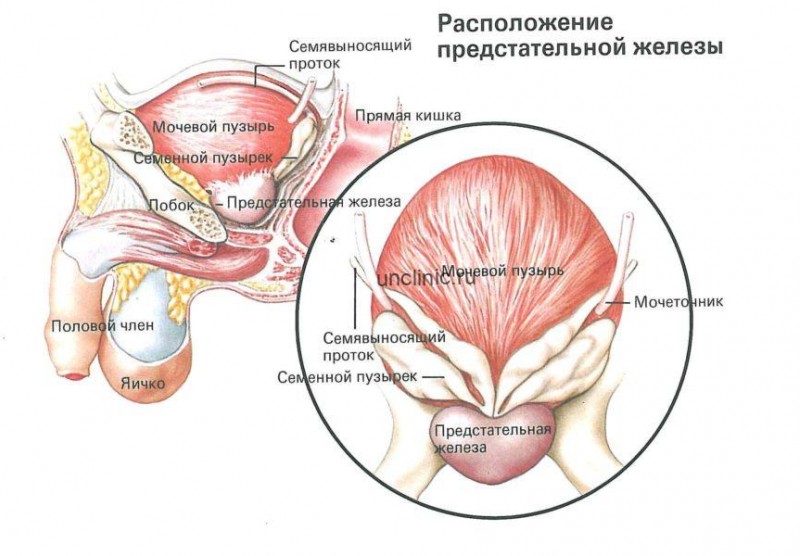
- диагностика воспаления предстательной железы (у мужчин);
- подготовительные действия к зачатию ребенка;
- выбор правильной схемы лечения при наличии мочеполовых инфекций;
- частая смена половых партнеров и пренебрежение механической контрацепцией (презерватив);
- внематочная беременность (наступившая или присутствовавшая в прошлом).
Серьезную опасность для здоровья женщины, особенно в период беременности, представляет заболевание уреаплазмозом. Поскольку чаще всего оно протекает бессимптомно, вызывая впоследствии ряд серьезных осложнений (эндометрит, воспаление матки и т. д.), то своевременное диагностирование инфекции помогает провести необходимую терапию и снизить риск инфицирования ребенка в процессе вынашивания и родов.
Значение биологического метода исследования
Анализ пробы бактерий имеет свое практическое применение. Прежде всего бактериологический метод исследования может использоваться в медицине. К примеру, необходимо изучить микрофлору больного, чтобы установить правильный диагноз, а также выработать правильный ход лечения. Здесь помогает антибиотикограмма, которая покажет активность лекарственных препаратов против возбудителя заболеваний.
Анализ бактерий используется в лаборатории для определения таких опасных заболеваний, как туберкулез, возвратный тиф или гонорея. Также он применяется для изучения бактериального состава миндалин, полостей органов.
Бактериологический метод исследования можно использовать для определения загрязненности среды. По данным о количественном и качественном составе мазка с поверхности какого-либо предмета определяется степень заселенности данной среды микроорганизмами.
Культуральный (бактериологический)
метод исследования — совокупность
способов, направленных на выделение и
идентификацию чистых культур
микроорганизмов (бактерий) с помощью
культивирования на питательных средах.
Чистая
культура — совокупность микроорганизмов
одного вида. Чаще всего чистую культуру
получают путем отбора и культивирования
изолированной колонии (потомство одной
микробной клетки).
Этапы метода:
1. Забор материала для исследования.
2. Выделение чистой культуры и ее
идентификация.
3. Заключение.
Забор материала для исследования.
Вид исследуемого материала зависит от
цели исследования (диагностика — от
больного; эпиданализ — из внешней среды,
продуктов питания, больного и (или)
бактерионосителя).
Выделение чистой культуры
. Включает
3 или 4 этапа:
1. Посев материала (после предварительной
микроскопии) на чашку с плотной питательной
средой (лучше дифференциально-диагностической
или селективной) с целью получения
изолированных колоний. Производят его
чаще всего методом механического
разобщения. В некоторых случаях (например,
кровь) материал предварительно засевают
в жидкую среду обогащения с последующим
пересевом на чашку с агаровой средой.
Иногда до посева проводят селективную
обработку материала (с учетом свойств
выделяемого микроорганизма; например,
обработка кислотой или щелочью для
выделения устойчивых бактерий).
Культивируют при температуре 37°С в
течение 18-24 часов. Время культивирования
для разных видов бактерий может
колебаться.
2(3):а) изучение колоний на чашке с агаром
(культуральные признаки), отбор наиболее
типичных; б) приготовление мазков из
этих колоний с окраской (по Граму или
другими методами); а) отсев остатка
исследованной колонии на среду
накопления и выращивание в термостате
при оптимальной температуре.
3(4). Изучение чистоты культуры, полученной
на среде накопления. С этой
целью готовят мазок, окрашивают (чаще
по Граму), микроскопически изучают
морфологическую и тинкториальную
однородность (в разных полях зрения).
4(5). Идентификация чистой культуры.
Заключение.
По совокупности
признаков в сравнении со свойствами
эталонных (типовых) штаммов указывается
вид выделенного из материала микроорганизма.
Оценка метода:
достоинства:
относительно высокая
чувствительность и точность, возможность
определить численность микробов в
исследуемом материале, а также
чувствительность к антибиотикам;недостатки:
относительная длительность,
метод дорогостоящий.
Микробиологическая диагностика эшерихиозов
Цель. Изучить
классификацию и особенности патогенеза
эшерихиозов. Овладеть методами оценки
результатов лабораторного исследования
для подтверждения диагнозов эшерихиозов.
Научиться практически решать вопросы
по использованию эубиотиков для коррекции
микрофлоры кишечника.
Теоретическая
справка
Кишечная
палочка была впервые выделена из
кишечника ребенка и определена как
бактерия–коменсал. Установлено, что
она может вызывать аутоинфекции на
фоне снижения резистентности
макроорганизма. По мере совершенствования
бактериологических методов диагностики
были выделены патогенные варианты E.coli, попадающие в организм
фекально-оральным путем. Наиболее
восприимчивы к этим инфекциям
новорожденные, так как через плаценту
не проходятIgM,IgA,
обусловливающих защиту при кишечных
инфекциях. В женском грудном молоке эти
иммуноглобулины содержатся в титрах
1:8-1:128. в течение 12-18 месяцев ребенок
получающий грудное молоко, более устойчив
к этим инфекциям.
Патогенные
варианты E.coliделятся на пять категорий по О-антигену:
1.Энтеропатогенные
(ЭПКП): 0111, 055, 0126.
2.Энтероинвазивные
(ЭИКП): 0152, 0124, 0144.
3.Этеротоксигенные
(ЭТКП): 0128, 085, 0148.
4.Энтерогеморрагические
(ЭГКП): 0157, 026, 0145.
5.Энтероадгезивные
(ЭАГКП) (структурная основа пока
неизвестна).
В лабораторной
диагностике эшерихиозов используется
первый принцип диагностики: обнаружение
возбудителя – метод бактериологиеский.
Выбор
исследуемого материала — испражнений
– определен локализацией патологического
процесса в кишечнике. Посев производят
на среду Левина или на среду ЭНДО –
темно-красные колонии с металлическим
блеском. Для выявления патогенных
вариантов кишечных палочек учитывают
антигенное строение этих микроорганизмов:
О-, К- и Н-антигены. Агглютинация с
ОК-сывороткой материала из колонии
позволяет определить наличие О-антигена,
свидетельствующего о патогенном варианте
этих бактерий. В то же время антиген
К(В) обусловливает О-инаглютинабельность
микроорганизмов, а о серогруппе эшерихий
судят по О-антигенам. Разрушение
термолабильных К- и Н-антигенов позволяет
определить принадлежность выделенных
бактерий к той или иной серогруппе.
Основные методы микроскопии
Микроскопия — это метод бактериологического исследования, при котором нечто, полученное от человека (кровь, слизь, гной, мокроту и т.п.), рассматривают под микроскопом. Вирусы таким образом увидеть невозможно, но бактерии, грибы, простейшие — очень даже можно рассмотреть.
Микроскопия — метод старинный, точность его невелика, но есть огромное преимущество: не надо долго ждать результата; взяли, к примеру, мазок из носа и бегом к микроскопу…
Насколько эффективна микроскопия?
Классический, но довольно-таки редкий пример эффективности метода микроскопии — диагностика дифтерии. При любом подозрении на дифтерию делается микроскопия мазка из зева, поскольку дифтерийные палочки имеют весьма специфический внешний вид. Дополнительное диагностическое значение микроскопии состоит еще и в том, что при ее проведении видны не только микробы, но и лейкоциты. Форма обнаруженных лейкоцитов помогает определить вид воспаления: много нейтрофилов — воспаление бактериальное, много эозинофилов — аллергическое.
Последовательность действий и особенности методики
Для проведения бактериологического исследования необходимо выполнить сбор материала и культивировать его на питательных средах с последующей микроскопией полученных штаммов и проверкой чувствительности к антибиотикам.
Сбор материала
Биоматериалом для исследования могут служить кровь, моча, ликвор, мокрота, сперма, кал, мазки из глотки, влагалища, уретры, любые другие ткани и жидкости из области инфекционного процесса. Образцы собирают в асептических условиях, помещают в стерильную посуду и в течение 2-х часов доставляют в лабораторию. При необходимости пробы хранят при пониженных температурах.
Культивирование
Культивирование проводят с применением механических или биологических методов. Механический подход с использованием стандартных искусственных сред – наиболее распространенный. В данном случае для высевания образцов используют жидкие и твердые питательные составы. Наиболее распространенные – агар, мясо-пептонный бульон.
Посев материала производят с помощью специальной петли или пастеровской пипетки, растирая полученный образец по поверхности или вводя его в толщу питательной среды. Выделение бактерий производят из чистых культур, которые получают повторным посевом ранее выращенных колоний на новую среду.
Биологические методы подразумевают использование специальных питательных сред, которые учитывают особенности микроорганизма, в частности, чувствительность к некоторым химическим веществам, в том числе антибиотикам. В некоторых случаях применяют метод заражения лабораторных животных или тканевых культур с отслеживанием патологических изменений. Такой подход актуален при крайне незначительном накоплении микроба в тканях человека – в этом случае его выделение посевом на питательных средах не дает результата.
Микроскопическое исследование
Основной метод бактериологической диагностики – бактериоскопия. Она подразумевает визуальную оценку параметров микроорганизма под микроскопом. Для этого используют фиксированные и нефиксированные препараты.
Нефиксированные препараты позволяют исследовать живые образцы бактерий. Основные методы:
- раздавленная капля – образец придавливают между предметным и покровным стеклами;
- висячая капля – образец помещают в лунку на предметном стекле и герметично накрывают покровным.В качестве среды используют изотонический раствор или расплавленный агар. Методика позволяет наблюдать за живыми микроорганизмами в течение нескольких дней.
Фиксированные препараты используют для окрашивания с подробным изучением морфологических и некоторых биохимических параметров патогенов. Каплю бактериального состава размазывают по предметному стеклу и фиксируют пламенем горелки или специальными химическими составами.
Для определения свойств бактериальных препаратов используют ряд общих и специфических методик:
- микроскопия – определение формы, размеров, окрашивания по Граму;
- биохимические методы – исследование ферментативной способности микроорганизма к расщеплению тех или иных углеводов, аминокислот, метаболитов, в том числе способность к гемолизу, фибринолизу при попадании в кровь живых существ;
- серологические методы идентификации – реакции агглютинации под воздействием специфической сыворотки и другие антигенные свойства;
- биологические методы – заражение лабораторных ждивотных с проверкой патогенности и токсигенности взятых образцов, их устойчивости к антибиотикам.
Только совокупный анализ результатов всех методов диагностики – микроскопических, биохимических, серологических, биологических – дает объективный результат для вынесения точного диагноза.
Регламентирующие документы
Исследование воды на наличие микроорганизмов регламентируется ГОСТами и СанПиНами. Основным документом является ГОСТ 18963-73. В нем зафиксированы способы бактериологического анализа воды, которая используется для питья.
В этом документе прописаны:
- способы отбора проб воды для исследования;
- правила их хранения;
- правила перевозки в лаборатории.
Также в ГОСТе прописана применяемая при теста аппаратура. Указаны используемые реактивы вместе с питательными средами. Подробно прописана подготовка к исследованию, сама процедура анализа.
- Применяется и ГОСТ 24849-2014. В этом стандарте прописаны методики бактериологического исследования воды в полевых условиях.
- Некоторые положения касательно анализа воды на наличие микроорганизмов зафиксированы в ГОСТе Р 51232-98. Там прописаны способы бактериологического исследования воды для питьевых нужд.
- В СанПиН 2.1.4 1074 01 зафиксированы требования касательно качества воды, идущей на питьевые нужды. В документе содержатся нормативы по бактериологическому составу питьевой воды, согласно которым она может считаться безопасной.