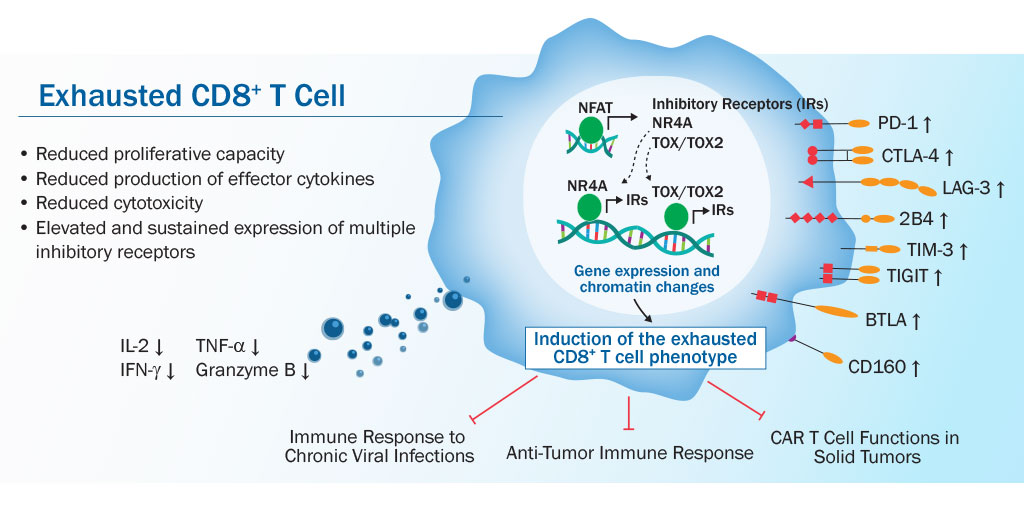
Что такое иммунитет. клеточный и гуморальный иммунитет
Содержание:
- Введение.
- Т-клетки и коронавирус
- От чего зависит?
- Вопрос 2. Антигены. Основные свойства и строение антигенов.
- Антитела исчезают, Т-клетки остаются
- 47.Интерфероны. Роль в иммунитете.
- Т-клетки и что о них нужно знать
- Другие факторы иммунитета
- Пересадка тканей.
- Клеточный
- Расшифровка: норма и патология
- 5.3. Гуморальный механизм специфического иммунного ответа
- Иммунохимический анализ крови: подготовка и расшифровка основных показателей
- Что такое иммунограмма?
- Характеристика механизмов клеточного специфического иммунитета (т-системы иммунитета)
- Иммунитет: зачем он нужен?
- Селекция антител.
Введение.
Термин клеточный
иммунитет (иммунитет, опосредованный
клетками) используют для описания такого
противоинфекционного или противоопухолевого
иммунного ответа, в котором антителам
(эффекторам гуморального иммунного
ответа) принадлежит не ведущая, а
вспомогательная роль.
В
отличие от В-системы
иммунитета
, которая нейтрализует антиген
с помощью антител, Т-система
иммунитета
уничтожает антигены, представленные
на клетках, через прямое взаимодействие
субпопуляции T-клеток — специфических
цитотоксических
T-клеток (CD8 T-клеток, T-киллеров)
с измененными собственными или чужеродными
клетками.
Вторая
отличительная черта Т-клеток
связана с особенностями распознавания
антигена: Т-клетки распознают не
собственно антигенный пептид (
эпитоп
), а его комплекс с молекулами I или II
классов МНС
.
В
тех случаях, когда антигенный пептид
образует комплекс, включающий молекулы
MHC
класса I
, распознавание и уничтожение
осуществляется, как только что упоминалось
выше, цитотоксическими
CD8 T-клетками
.
В
тех же случаях, когда антигенный пептид
образует комплекс с молекулами MHC
класса II
, в процесс взаимодействия с таким
комплексом вступают либо CD4
Т-клетки воспаления (ТН1)
, либо хелперные
CD4 Т-клетки (ТН2)
. (Прежнее название клеток субпопуляции
TH1 — Т-индукторы
).
Если
наивные
Т-клетки
распознают комплекс на поверхности
макрофагов
, поглотивших патоген, то такие клетки
дифференцируются в CD4
Т-клетки воспаления (ТН1)
, активируют эти макрофаги и тем самым
способствуют внутриклеточному
перевариванию (уничтожению) патогена.
Путь
проникновения антигена в клетку может
осуществляться не только за счет
неспецифической адгезии
патогена на поверхности макрофагов, но
и посредством специфического взаимодействия
с предсуществующими антигенраспознающими
рецепторами В-клеток (поверхностными
иммуноглобулинами)
. Экспрессия переработанного антигена
в комплексе с молекулами II класса на
поверхности В-клеток вызывает ответ
наивных Т-клеток, дифференцирующихся
в хелперные
CD4 Т-клетки (ТН2)
. В этом случае хелперные Т-клетки
оказывают помощь В-клеткам
в продукции антител
, т.е. в формировании гуморального
иммунного ответа
.
В табл.
1
представлены сравнительные характеристики
особенностей проявления клеточного
иммунного ответа
и гуморального
иммунного ответа.
Табл. 1 Сравнительная
характеристика проявлений клеточного
и гуморального иммунного ответа
|
Признак |
Клеточныйиммунитет |
Гуморальный |
|
|
Патоген |
вирусы (вирус гриппа, |
бактерии, простейшие |
бактерии и их токсины |
|
Локализация и |
цитозоль |
вакуоли макрофагов |
внеклеточная жидкость; |
|
Презентация антигена |
комплекс антигенного |
комплекс антигенного |
комплекс антигенного |
|
Эффекторные Т-клетки |
цитотоксические CD8 |
CD4 Т-клетки воспаления |
хелперные CD4 Т-клетки |
|
Эффекторное действие |
лизис инфицированных |
уничтожение |
синтез специфических |
Т-клетки и коронавирус
Так как большинство людей раньше не подвергались воздействию нового коронавируса (на то он и новый), у них нет Т-клеток памяти и, соответственно, защиты от инфекции. Хорошая новость в том, что инфицированные люди при этом могут генерировать COVID-специфические Т-клетки. Причём, как показало исследование шведских учёных, это происходит также у пациентов со слабыми симптомами или вообще без них. И даже в том случае, если в организме нет антител.
А ещё обнаружилось, что некоторые неинфицированные люди имеют Т-клетки к COVID-19. Это, вероятнее всего, является перекрёстной реактивностью — совпадением с реакцией организма на предыдущие коронавирусные инфекции. Когда учёные посмотрели на образцы крови, взятые за несколько лет до начала пандемии, и обнаружили в них Т-клетки, приспособленные к обнаружению белков на поверхности COVID-19, теория подтвердилась.
От чего зависит?
Продолжительность иммунитета зависит от иммуногенности возбудителя, то есть его способности активировать иммунный ответ. Если особь заразилась инфекцией и переболела, она получает натуральный активный иммунитет. Если была получена вакцина, иммунитет будет также активным, но искусственным. Оба класса реакции – самые продолжительные из возможных.
Относительно недолговременный иммунитет формируется при получении младенцем от материнского организма антител в период нахождения в утробе. Эти антитела – залог здоровья малыша в первые несколько месяцев после рождения. Иммунитет, полученный таким образом, пассивен, а в силу своего происхождения считается натуральным.
Пассивный искусственный можно получить, если был поставлен укол сыворотки, в которой присутствуют антитела против некоторой микроскопической формы жизни или ядовитого соединения. Эффективность инъекции сохраняется несколько недель, после чего полностью пропадает.
Вопрос 2. Антигены. Основные свойства и строение антигенов.
Антигенами
называют вещества любого происхождения,
в том числе микробного, которые
распознаются клетками иммуннной системы
организма реципиента как генетически
чужеродные и вызывают различные формы
иммунного ответа.
Антигенами
являются чаще белки и их соединения с
углеводами (гликопротеиды), липидами
(липопротеиды), нуклеиновыми кислотами
(нуклеопротеиды).
Свойства
антигенов:
-
антигенность
– способность антигена индуцировать
в организме человека иммунный ответ,
например, образование антител, -
специфичность
– способность антигена взаимодействовать
только с гомологичными антителами.
Антигены бывают
полные или неполные (гаптены). Полные
обладают обоими свойствами. Гаптены не
способны индуцировать образование
антител, но способны взаимодействовать
с готовыми.
Антитела исчезают, Т-клетки остаются
Т-клетки (Т-лимфоциты) хранят информацию о ранее выявленных иммунной системой в организме антигенах и формируют долговременный иммунитет к перенесенным инфекционным заболеваниям. Из разных стран поступают сообщения о том, что Т-клетки, специфичные к SARS-Cov-2, есть даже у людей, которые перенесли инфекцию бессимптомно и не выработали антитела. Ученые НМИЦ гематологии выяснили, что Т-клетки, которые «узнают» коронавирус, обнаруживаются даже в образцах крови, взятых еще до пандемии. Этот феномен исследователи объясняют перекрестным иммунитетом, вызванным ранее перенесенными коронавирусными инфекциями.
«Мы получаем все больше сведений, что Т-клетки, как минимум, не менее важный защитный механизм против COVID-19, чем антитела. Это подтверждается тем, что у многих, особенно легко и бессимптомно переболевших, не вырабатываются антитела, а Т-клетки присутствуют. Исследования показывают, что уже через полгода у значительной части переболевших количество антител сильно снижается, а у некоторых они и вовсе исчезают. Т-клеточный ответ потенциально сохраняется гораздо дольше», — сообщил МедПорталу сотрудник лаборатории трансплантационной иммунологии НМИЦ гематологии Алексей Титов.
Массово протестировать людей на Т-клеточный иммунитет пока технически невозможно: такие исследования проводятся только в специализированных лабораториях практически вручную. Специалисты НМИЦ-гематологии работают над созданием тестов на Т-клетки, которые позволят выявлять переболевших на более длительной временной дистанции, чем антитела.
«Технология основана на зарекомендовавшем себя методе выявления реагирующих на вирус Т-клеток, однако нашим ноу-хау является конкретный набор фрагментов коронавирусных белков, который мы тщательно отбираем, отсекая те, что могут дать ложно-позитивную реакцию Т-клеток, — рассказал Алексей Титов, — Эти тесты смогут в спорных случаях подтвердить факт прошлой коронавирусной инфекции, а также использоваться для оценки эффективности вакцинации».
47.Интерфероны. Роль в иммунитете.
Интерферон был
описан в 1957 году как активная субстанция
в аллантоисной жидкости эмбрионов кур,
образованных инактивированным вирусом
гриппа. Эта субстанция индуцировала
устойчивость к действию различных
вирусов. В 70-х годах появилось понятие
«иммунный интерферон», т.е.интерферон,
образующийся в процессе иммунной
стимуляции.
Кроме противовирусной
активности у ИНФ была обнаружена
противоопухолевая и иммунорегуляторная
активность.
В настоящее время
интерфероны выделены в особый класс
цитокинов.
В 1980 году принята
номенклатура интерферонов, согласно
которой выделяют интерфероны:
-альфа (макрофагальный)
-бета (фибробластный)
-гамма (лимфоцитарный,
иммунный)
Альфа интерферон
клетки
продуценты-В-лф
и макрофаги,Индукроры-
опухолевые клетки, вирустрансформированные
клетки, вирусы
Бета интерферон
КЛЕТКИ
ПРОДУЦЕНТЫ – фибробласты и эпителиоидные
кл-ки, макрофаги, NK-клетки,
Т- и В- лимфобласты, ИНДУКТОРЫ= РНК вирусов
и бактерий, синтетические РНК, митогены
Т-клеток
Гамма интерферон
КЛЕТКИ
ПРОДУЦЕНТЫ-Т-лф, , NK-клетки,
моноциты, макрофаги. ИНДУКТОРЫ=Т-клеточные
митогены(лектины, оксиданты) и большинство
микроорганизмов
Т-клетки и что о них нужно знать
Из школьной программы многие помнят, что за иммунитет у нас ответственны лимфоциты. Существует два типа лимфоцитов: В-клетки, которые образуются и созревают в костном мозге, и Т-клетки, которые также образуются в костном мозге, но созревают в вилочковой железе (тимусе), расположенной в верхнем отделе грудной клетки. В организме они работают вместе, но Т-клетки всё равно круче.
Дело в том, что Т-клетки нацелены на выявление и устранение специфических инородных частиц. Вместо того, чтобы атаковать все антигены подряд (а это бактерии, вирусы, токсины и даже пыльца — всё, что заставляет организм вырабатывать антитела), Т-клетки циркулируют до тех пор, пока не столкнутся со «своим» антигеном. Они определяют его с помощью белков на поверхности, которые могут связываться с белками на поверхности антигенов. Существуют триллионы вариантов этих поверхностных белков, каждый из которых может распознать собственную мишень.
Роль Т-клеток немного меняется на протяжении жизни. В детстве с их помощью у нас формируется иммунитет к общим патогенам и создаётся запас Т-клеток памяти. Они буквально запоминают реакцию на те или другие антигены, поэтому, встречая их в будущем, реагируют быстрее и эффективнее (это называется вторичным иммунным ответом). Дальше Т-клетки в основном занимаются иммунорегуляцией и работой с повторяющимися или постоянно присутствующими (при наличии хронических заболеваний) в организме антигенами. С возрастом их количество снижается, так что чем мы старше, тем слабее становится наш иммунитет.
Т-клетки тоже бывают разных типов. Т-хелперы, например, помогают активности других иммунных клеток, высвобождая информационные молекулы цитокины. Они стимулируют созревание В-клеток, которые уже начинают вырабатывать антитела для нейтрализации патогена. А Т-киллеры (цитотоксические T-лимфоциты) самостоятельно убивают повреждённые или инфицированные клетки организма.
Другие факторы иммунитета
Каждый вид защиты организма от чужеродных агентов обладает своими, скажем так, исполнителями, которые стремятся уничтожить патогенное образование или хотя бы воспрепятствовать его проникновению в систему. Повторим, что иммунитет по одной из классификаций бывает:
1. Врожденный.
2. Приобретенный. Бывает активным (появляется после прививок и некоторых заболеваний) и пассивным (возникает в результате передачи антител младенцу от матери или введения сыворотки с готовыми антителами).
По другой классификации иммунитет бывает:
- Естественный (включает 1 и 2 типы защиты из предыдущей классификации).
- Искусственный (это тот же приобретенный иммунитет, появившийся после прививок или некоторых сывороток).
Врожденный тип защиты обладает следующими факторами:
- Механические (кожа, слизистые, лимфоузлы).
- Химические (пот, секреты сальных желез, молочная кислота).
- Самоочищение (слезы, шелушение, чихание и прочие).
- Антиадгезивные (муцин).
- Мобилизуемые (воспаление инфицированного участка, иммунный ответ).
Приобретенный тип защиты имеет только клеточные и гуморальные факторы иммунитета. Рассмотрим их подробнее.
Пересадка тканей.
Еще один важный иммунологический феномен, связанный с изоантителами, наблюдается при трансплантации тканей. Гомотрансплантаты, т.е. ткани одного и того же организма или однояйцовых близнецов (например, при пересадке кожи или пластических операциях), обычно хорошо приживляются на новом месте. Иммунологическая реакция не развивается, так как гены и кодируемые ими белки в пересаженной ткани и клетках реципиента абсолютно одинаковы. Если же ткань взята от донора, не связанного с реципиентом близким родством, она может сохраняться на месте пересадки некоторое время, но затем отторгается. Следующий трансплантат от нового донора отторгается еще быстрее. Такое отторжение имеет иммунологическую природу – об этом свидетельствует успех трансплантации в случае сходной антигенной специфичности тканей донора и реципиента
Подбор донора по тканевой совместимости с реципиентом имеет жизненно важное значение при пересадках сердца, почек и других органов
Гены, ответственные за приживляемость или отторжение пересаженной ткани, образуют т.н. «главный комплекс гистосовместимости». Они кодируют синтез не только тканевых антигенов, определяющих успех или неуспех трансплантации, но и некоторых рецепторов на поверхности T-клеток. Определение продуктов этих генов помогает заранее определить, будет ли организм реагировать на специфические антигены пересаженной ткани.
В некоторых условиях, в частности после контакта с каким-либо антигеном в период внутриутробного развития, развивается толерантность, т.е. неспособность реагировать на этот антиген в течение последующей жизни (см. также ПЕРЕСАДКА ОРГАНОВ).
Клеточный
Осуществляется за счет захвата особыми клетками (антигенпрезентирующими) микроорганизмов либо токсинов. В этих клетках происходит их частичная нейтрализация и анализ. Затем информация о возбудителе поступает от этих клеток к фагоцитам (Т-киллерам, NK-клеткам), которые «настраиваются» на уничтожение соответствующего возбудителя, либо мутировавших клеток.
Процесс настройки заключается в изменении либо появлении новых рецепторов на мембране лейкоцитов. Это позволяет им найти и уничтожить болезнетворные микробы, зараженные вирусами клетки, либо переродившиеся в злокачественные.
Клеточны ответ может протекать не только в форме фагоцитоза. Т-киллеры при обнаружении опасной клетки могут выделить на ее мембрану особые белки – перфорины. При взаимодействии с клеткой мишенью они создают отверстия в ее оболочке, через которые Т-киллер впрыскивает токсины, уничтожающие клетку.
Еще один механизм защиты – запуск процесса апоптоза, то есть самоуничтожения клетки, переродившейся в опухолевую либо зараженную вирусом. Осуществляется также за счет выделения специфических белков. Они соединяются с мембраной клетки-мишени и запускают процесс самоуничтожения. Так уничтожается подавляющее большинство раковых клеток, которые ежедневно образуются в организме в больших количествах.
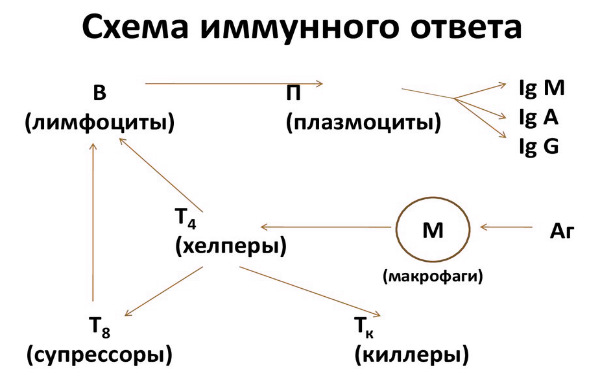
Расшифровка: норма и патология
Отклонение показателей от нормы – тревожный признак!
Расшифровкой иммунохимического анализа занимается врач. Иммунохимический анализ довольно сложный, он включает множество показателей и имеет множество нюансов. Расшифровывать его самостоятельно не рекомендуется.
Стоит помнить, что для постановки диагноза, учитывается не только результат проведенного обследования, но и собранный анамнез, их совокупность и прочие факторы.
Расшифровка основных показателей анализа:
- Иммуноглобулин А. В норме он составляет 15% от всего количества иммуноглобулинов в крови. Если показатель повышен, это может указывать на красную волчанку, заболевания печени, почек, соединительной ткани. Пониженный уровень наблюдается при циррозах и отравлениях.
- Иммуноглобулин Е. Обычно говорят только о повышении этого иммуноглобулина. Повышенный уровень указывает на наличие паразитов в организме или атопические аллергические реакции (отеки, ринит, сыпь, покраснение и зуд кожи, экзема, крапивница).
- Иммуноглобулин М. Составляет не более 5% от всего количества иммуноглобулинов. Его уровень повышается при инфекциях различной этиологии в острой форме, при кандидозах, серьезных поражениях печени, красной волчанке.
- Пролактин. У мужчин норма более четкая, так как у женщин она зависит от состояния организма и цикла. Для мужчин норм составляет 105- 540 мМЕ/л, для женщин – от 65 до 726 мМЕ/л. В нормальном состоянии у женщин уровень повышается при лактации. Также на уровень пролактина влияют некоторые препараты и такие заболевания, как туберкулез, поликистоз яичников, опухоли гипофиза.
- Лютеотропин. Уровень этого гормона у женщин меняется с течением цикла, а у мужчин составляет от 1,14 до 9 мЕд/л. Пониженный уровень встречается при опухолевых процессах гипофиза, ожирении, аменорее, повышенный – при поликистозе яичников, почечной недостаточности, эндометриозе, длительном голодании.
При расшифровке результатов важно учитывать наследственную предрасположенность пациента к заболеванию, его состояние (цикл, беременность, наличие хронических заболеваний), а также вероятность ошибки и неправильной подготовки
5.3. Гуморальный механизм специфического иммунного ответа
Важнейшими
участниками гуморального механизма
иммунных реакций являются антитела.
Именно они во внеклеточных жидких средах
организма нейтрализуют и опсонизируют
чужеродные частицы, а также активируют
систему комплемента и фагоцитоз.
Нейтрализация проявляется потерей
способности антигенов повреждать
клетку-мишень.Опсонизациячужеродных
частиц повышает активность их фагоцитоза.Активация классического путисистемы комплементакомплексами
антигена с антителом усиливает опсонизацию
патогена, вызывает хемотаксис фагоцитов
и рост мембранолитической активности.
Антитела
вырабатываются после стимуляции
В-лимфоцитов антигеном. Часть его молекул
поглощается В-клеткой и разрушается на
фрагменты, которые затем в комплексе с
молекулами ГКГС возвращаются на
поверхность В-лимфоцита и там распознаются
Т-хелперами второго типа.
Для развития
иммунного ответа B- и T-клетки, не
обязательно должны распознать одни и
те же фрагменты одного тимусзависимого
антигена. Например, вирусы поглощаются
B-клетками, которые на своей поверхности
одновременно формируют комплексы
молекул ГКГС с иммуногенными группами
внешних и внутренних вирусных белков.
Благодаря этому, B-клетка стимулируется
реагирующими на внутренние антигены
вируса Т-хелперами второго типа, а сама
секретирует антитела к поверхностным
антигенам (так как первая встреча была
с ними). Такое
явление названо сцепленным
распознаванием.
Антитела
взаимодействуют с антигенами только
во внеклеточной среде макроорганизма.
Следовательно, нейтрализация ими вирусов
и бактерий, обитающих внутри клеток,
возможна только при попадании патогенов
в плазму крови или межклеточные
пространства.
Однако, концентрация
соответствующих антител при первичном
иммунном ответе достигает достаточного
для нейтрализации патогенов уровня в
то время, когда вирусы и бактерии уже
«спрячутся от антител» в клетках-мишенях.
Вторичный (более
быстрый и эффективный) иммунный ответ
развивается лишь на тимусзависимые
антигены при их очередном попадании во
внеклеточные среды макроорганизма. Это
наблюдается во время перехода антигенов
в новые клетки-мишени, в случае повторного
инфицирования животного или после
своевременной вакцинации.
Если входные ворота
вирусной инфекции являются одновременно
и мишенью (например, эндотелий воздухоносных
путей при аэрогенном заражении), антитела
могут выполнять свою защитную функцию
только вне кровеносного русла благодаря
их секреции (преимущественно sIgA)
на поверхность слизистых оболочек и в
межклеточных пространствах при переходе
вируса из одной клетки в другую. Низкая
эффективность такого механизма иммунной
защиты при первой встрече с антигенами
связана с тем, что первичный иммунный
ответ развивается медленно (концентрацииIgвозрастают не ранее чем
через 7 суток) и сопровождается выработкой
низкоафинных, находящихся в основном
в кровеносном руслеIgM. В
это же время образуются долгоживущие
клетки памяти, которые при новом контакте
с тем же тимусзависимым антигеном
способствуют кооперации
специфичных к нему B- и T-лимфоцитов с
одной антигенпредставляющей клеткой.
Это обеспечивает быстрое (в течение
двух-трех дней) образование достаточного
для защиты количества высокоаффинных
антител.
Следовательно,
для непосредственного
формирования иммунной реакции на
тимусзависимые
антигены характерны следующие этапы:
1.
Обработка
антигена антигенпредставляющими
клетками.
2. Стимуляция
тех В- и Т-эффекторных клонов, которые
реагируют на обнаруженный антиген.
Активированные Т-хелперы первого типа
способствуют развитию клеточных, а
второго типа – гуморальных механизмов
специфической защиты.
3.
Поддержание
и регуляция необходимого уровня
активности иммунного ответа.
Иммунохимический анализ крови: подготовка и расшифровка основных показателей
Если пара не может зачать ребенка или только его планирует и хочет предотвратить возникновение проблем, гинеколог и андролог направит обоих партнеров на анализ крови для определения уровня гормонов.
Расшифровка результатов исследования даст возможность понять, где скрывается проблема и каким образом ее можно устранить.
Это исследование не является профилактической мерой. Его принято назначать при таких показаниях:
- Генетическая склонность к иммунным патологиям. Анализ позволяет выявить малейшие сбои в функциональности иммунитета. Такие нарушения в скором времени провоцируют развитие иммунодефицита, истинную причину которого определить очень трудно. Нередко иммунные заболевания имеют генетическую предрасположенность и внезапно проявляются в любом возрасте.
- Подозрение на онкологические патологии. Анализ охватывает и онкомаркеры. Он показывает не только присутствие злокачественных клеток, но и показывает процентную предрасположенность пациента к образованию опухолей.
- Проблемы с зачатием. Семейные пары, которые испытывают трудности в зачатии ребенка на протяжении длительного времени, могут пройти анализ на половые гормоны, чтобы определить причину и степень совместимости с партнером.
- Недуги аутоиммунного характера. Они возникают в результате нарушения нормальной работы иммунитета, который выступает по отношению к собственному организму агрессором, а не защитником.
Аутоиммунное заболевание
Забор крови для иммунохимического анализа не отличается от биохимического анализа. Лаборант берет у пациента венозную кровь. Далее сыворотка анализируется специальным лабораторным устройством. Благодаря техническому прогрессу результат анализа можно получить уже через полчаса после забора крови, но в нашей стране большинство лабораторных учреждений выдают его через 2-3 дня после процедуры.
Подготовительные меры не отличаются сложностью и длительностью. Для получения максимально точного результата пациент должен:
- Не есть за 12 часов до забора крови.
- Проходить процедуру на пустой желудок.
- Сдавать кровь до 11 часов дня.
Разрешается выпить перед процедурой 200-250 мл чистой воды.
Хотя этот анализ не включает в себя печеночные пробы и показатель ТТГ, специалисты рекомендуют за 3-4 дня до анализа исключить из ежедневного рациона жирные блюда и пищу, обогащенную белком. Данный запрет связан с тем, что эти вещества делают кровь более вязкой, из-за чего сыворотка мутнеет и усложняет обследование.
Нежелательно курить за 24 часа до анализа. Как показывает статистика, лишь 8 процентов пациентов придерживаются этой рекомендации. Из-за этого врачи просят не принимать никотин хотя бы в то утро, когда будет проходить процедура.
Жирное блюдо
Женщинам-пациенткам нужно обязательно предупредить своего лечащего врача о фазе месячного цикла. День, когда будет происходить забор крови, сильно влияет на концентрацию половых гормонов, поскольку этот показатель связан с менструальным циклом. Если анализ проходит будущая мамочка, врач должен учитывать срок вынашивания ребенка.
Продукты, обогащенные белком
Один из важнейших подготовительных аспектов – прием медикаментозных средств. В идеале пациент обязан прекратить пить лекарства за неделю-полторы до анализа, но если это невозможно, то врач должен учитывать все эти нюансы при расшифровке показателей.
Категорически запрещено сдавать анализ после физических нагрузок или эмоционального стресса, поскольку эти процессы влияют на химический состав крови. Перед тем как зайти к лаборанту, пациент должен посидеть спокойно хотя бы 25 минут.
Что такое иммунограмма?
Это специальный анализ крови, который позволяет оценить количество различных иммунных клеток, вырабатываемых ими антител и ряда других веществ, свидетельствующих о состоянии защитных систем организма. В зависимости от цели исследования и возможностей лаборатории, количество исследуемых параметров может существенно варьироваться. Расширенное исследование позволяет изучить более 25 различных показателей – такой анализ выявляет даже скрытые нарушения, которые невозможно обнаружить стандартными методиками.
Иммунитет человека можно условно разделить на два звена – «медленное» (гуморальное) и «быстрое» (клеточное). Быстрое звено реагирует практически сразу после попадания возбудителя болезни (вируса, гриба, бактерии, простейших и т.д.) в организм. В задачу этой группы клеток входят следующие функции:
- Поглотить и «переварить» вредоносного агента;
- Презентировать или «рассказать» о патогенном микроорганизме другим иммунным клеткам, которые не могут самостоятельно его обнаружить;
- Уничтожить наибольшее количество выявленных микробов;
- Бороться с различными опухолями и аутоиммунными процессами – еще одна важная функция иммунитета, которая часто не позволяет организму самостоятельно справиться с болезнью.
После того, как «быстрое» звено поглотило чужеродное тело и рассказало о нем «медленному» звену, запускается медленный процесс создания и выброса антител в кровь. Антитела – это вещества, уничтожающие определенный вид патогенного агента. Они очень специфичны и, в большинстве случаев, помогают организму окончательно справиться с имеющимся заболеванием. В среднем, продолжительность их создания составляет 2-3 недели.
Показатели иммунограммы отражают работу каждого из звеньев защиты. Именно на основании их изменений делается вывод об отсутствии/наличии иммунодефициты, о варианте нарушения и оптимальном методе терапии.
| Звено иммунитета, исследуемый параметр | Функция |
| Цитотоксические Т-клетки (CD3+, CD8+) | Распознавание вредоносных микроорганизмов и их уничтожение |
| Т-хелперы (CD4+) | «Рассказывают» о наличии патогена другим клеткам-защитникам, играют существенную роль в формировании длительного иммунитета. |
| Т-супрессоры (CD8+) | Регуляция активности защитных систем, предохраняют организм от развития аутоиммунных реакций (когда вырабатываются антитела против здоровых тканей) |
| Т-клетки с рецептором для ИЛ-2 (CD25+) | |
| Носители маркера апоптоза (CD95+) | Контроль скорости процесса самоуничтожения клеток |
| В-клетки (CD+, 19CD+) | Отвечают за выработку специфических антител. В большинстве случаев, именно благодаря данному пулу клеток происходит полное выздоровление.
Защищают организм от повторного заражения той же самой инфекцией, в течение определенного времени. |
| Иммуноглобулин G | Антитела, вырабатываемые В-клетками. При связывании с вредоносным микробом – разрушают его стенку, вследствие чего наступает гибель. |
| Иммуноглобулин M | |
| Иммуноглобулин A | |
| Иммуноглобулин | Отвечает за развитие любых аллергических реакций. |
| стественные/натуральные киллеры (CD16+) или NK-клетки | Обеспечивают естественный противоопухолевый иммунитет |
| Клетки с HLA маркером | Отражает активность работы иммунных механизмов |
| Фагоцитоз | Распознавание, поглощение и презентация Т-клеткам вредоносных агентов |
| Реакция торможения миграции лейкоцитов (сокращенно – РТМЛ) | Лабораторный тест, отражающий работу клеточного звена. |
| НСТ-тест | Позволяет оценить активность фагоцитоза |
| Комплемент | Предотвращает формирование больших по размеру иммунных комплексов (соединений вредоносных частиц с антителами). Участвует в нейтрализации микробов |
В некоторых случаях, доктор может порекомендовать дополнить анализ исследованием содержания интерлейкинов в крови – это специальные вещества, которые обеспечивают взаимосвязь различных компонентов защитных систем. При нарушении их выработки также могут формироваться иммунодефицитные состояния.
Характеристика механизмов клеточного специфического иммунитета (т-системы иммунитета)
Т-система иммунитетавключает:
-
тимус(корковое его вещество,
являющееся местом дифференцировкипотомков стволовой клетки, мигрирующих
из красного костного мозга и являющихся
предшественниками Т-лимфоцитов (т.н.
пре-Т-клеток), допотенциально зрелых
форм(стадии наивных Т-лимфоцитов,
проявляющих специфичность в отношении
определенного антигена, но при этом
еще не способных развить иммунный
ответ) -
различные субпопуляции собственно
зрелых Т-лимфоцитов(Т-киллеров,
Т-клеток воспаления, Т-хелперов,
Т-супрессоров (в настоящее время
рассматриваются не как самостоятельная
субпопуляция, а как разновидность
Т-киллеров, в некоторых случаях
приобретающих способность подавлять
иммунные реакции), Т-клеток памяти).
Распределение Т-лимфоцитов в периферических
органах иммунной системы различно.
Так, в лимфатических узлах более 70%
клеток представлено Т-лимфоцитами,
среди которых 30% составляют Т-киллеры,
а 40% – Т-хелперы. В органах, несущих
основную нагрузку по продукции антител,
– селезенке, лимфоидных фолликулах –
Т-лимфоциты составляют не более 30% от
общего количества лимфоцитов. Заселение
периферических лимфоидных органов
Т-лимфоцитами контролируется целым
наборомадгезивных молекул,
представленных как на поверхности
Т-лимфоцитов, так и на поверхности
эндотелия сосудов и клеток тех органов,
которые заселяются лимфоцитами.Основными адгезивными молекуламиявляютсяселектины, интегрины,
муциноподобные молекулы, адгезины
суперсемейства иммунноглобулинови ряд других. Причем процесс перехода
Т-лимфоцитов из крови в паренхиму
лимфоидных органов включает несколько
этапов, предполагающих взаимодействие
Т-лимфоцита с эндотелием венул и
последующее проникновение Т-лимфоцита
через эндотелий в паренхиму органа -
группу цитокинов, продуцируемых
преимущественно зрелыми Т-лимфоцитами
(хотя некоторые цитокины могут
продуцироваться и наивными Т-лимфоцитами).
При этом Т-лимфоциты продуцируют около
20 цитокинов из примерно 30, вырабатываемых
лимфоцитами.
Иммунитет: зачем он нужен?
Иммунная система отвечает за антигенный гомеостаз. В принятой в науке терминологии иммунитетом именуют невосприимчивость к определенному типу патологических микроскопических форм жизни и продуктов их жизнедеятельности, а также ядов, генерируемых животным. Иммунная система принимает участие в опознании и деструкции самых разных клеточных структур – бактерий и вирусов, паразитарных, простейших, грибковых, опухолевых. Иммунный ответ, возникающий при этом – это реакция на инвазию.
Эволюция – особенность, присущая любой форме жизни, но особенно ярко она прослеживается, если наблюдать за микроорганизмами. Свойства микроскопических форм жизни постоянно совершенствуются, и единственным эффективным ответом на это со стороны макроорганизмов оказалось формирование иммунитета разных видов. Впрочем, иммунитет не единственное, что защищает человека. Немалую роль играют факторы, не допускающие инвазию. К примеру, проникновение патологической микрофлоры в человеческий организм затруднено за счет эпителиальных ресничек, кожных покровов, слизистых, а также высокой кислотности желудочной среды.
Селекция антител.
Этот процесс определяет, какие именно антитела должны образоваться, чтобы бороться со специфическим антигеном, выделяя его из миллиардов других антигенов, потенциально угрожающих организму. Механизм такой селекции остается еще не до конца ясным. Рассуждая логически, трудно предположить, что в каждом лимфоците содержится информация для синтеза миллиардов разных антител, большинство из которых никогда не пригодится. Одна из ранних теорий, получившая название «инструктивной», постулировала, что антитела синтезируются в незавершенном виде. Когда же антиген попадает в организм, он действует как матрица, на которой происходит окончательное формирование узнающего участка антител; иными словами, сам антиген служит «инструкцией» для создания специфичных именно к нему антител.
В настоящее время известно, что структура белковой молекулы антитела зависит от последовательности и взаимного расположения составляющих ее «кирпичиков» – аминокислот и что внешние причины, в том числе антигены, не могут вызвать существенных структурных перестроек. Поэтому была выдвинута новая теория – «клональной селекции». Согласно этой теории, в организме человека содержится около 10 млрд. слегка отличающихся друг от друга разновидностей лимфоцитов, причем каждая из них весьма немногочисленна. Когда антиген попадает в организм, он связывается только теми лимфоцитами, которые способны узнавать его. Связывание с антигеном создает стимул для их деления; в результате образуется большое число одинаковых клеток – клон, и численность отобранного варианта клеток быстро достигает необходимого уровня.
Теория клональной селекции не давала объяснения, каким образом исходно возникает колоссальное разнообразие лимфоцитов или их предшественников. Однако недавно механизм такой диверсификации как будто прояснился. Показано, что гены клеток, участвующих в иммунной реакции и продукции специфических антител, претерпевают частые случайные изменения за счет перегруппировок их отдельных участков; соответственно меняется закодированная в них информация, т.е. появляются новые, разнообразно измененные по этому признаку клетки, а в целом вся популяция лимфоцитов приобретает способность реагировать с разными антигенами. Кроме того, на протяжении многих клеточных поколений, требующихся для превращения стволовых клеток в зрелые лимфоциты, происходят случайные мутации в генах, кодирующих антитела. Эти мутации дополнительно увеличивают разнообразие лимфоцитов. Примечательно, что те молекулы на поверхности Т-лимфоцитов, которым они обязаны своей специфичностью, имеют во многом ту же структуру, что и циркулирующие в крови антитела, вырабатываемые В-лимфоцитами.